-
化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法正确的是
①汽车尾气的大量排放影响了空气的质量,但是不会造成PM2.5值升高
②研发安全特效药物,有利于人类抵御疾病
③规范食品添加剂的生产并科学使用,有利于保障人体健康和生命安全
④推广城市生活垃圾处理的减量化、资源化、无害化技术,有利于环境保护和资源充分利用
⑤用聚氯乙烯代替聚乙烯作食品包装袋,有利于节约使用成本
A.②③④ B.②④⑤ C.①③④ D.①②③
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.Na2O和Na2O2的混合物共1mol,阴离子数目在NA~2NA之间
B.1mol OH-和1mol -OH (羟基)中含有的质子数均为9NA
C.铁做电极电解食盐水,若阴极得到NA个电子,则阳极产生11.2L气体(标准状况下)
D.某密闭容器盛有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
常温下,下列溶液中可能大量共存的离子组是
A.某中性溶液中: Na+、Fe3+、SO42-、NO3-
B.某无色溶液中: K+、Mg2+、ClO-、SO42- Fe2+
C.能使KSCN变红的溶液中: NH4+、Na+、SiO32-、HCO3-
D.水电离产生的c(OH-)=1×10-10mol/L的溶液中: Al3+、SO42-、NO3-、Cl-
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍。下列说法正确的是
X
Y
Z
W
A.四种短周期元素中W的原子半径最小
B.Z元素在周期表中的位置是第三周期第ⅣA族
C.原子最外层电子数由多到少的顺序:Y>X>W>Z,最高正价由高到低顺序:W>Z
D.元素非金属性由强到弱的顺序: W> Z,W的单质常温下可与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧Y形管中放置的药品组合符合要求的是(必要是可以加热)

①Cu和浓硝酸 ②CaO和浓氨水 ③大理石和稀盐酸
④高锰酸钾溶液和浓盐酸 ⑤过氧化钠和水
A.只有①② B.只有③⑤ C.只有①②③ D.只有①②④⑤
难度: 困难查看答案及解析
-
下列说法正确的是
A.已知C2H6的燃烧热为1090 kJ·mol-1,则C2H6燃烧的热化学方程式为:
C2H6(g)+3.5O2(g)===2CO2(g)+3H2O(g) ΔH=-1090 kJ/mol
B.已知2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,则CO的燃烧热
ΔH=-283 kJ
C.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度即盐酸起始温度、NaOH起始温度和反应后终止温度
D.在稀溶液中:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量
难度: 中等查看答案及解析
-
某恒温密闭容器中,可逆反应A(s)
B+C(g) ΔH= +Q kJ·mol-1(Q>0)达到平衡。缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等。以下分析正确的是
A.产物B的状态只能为固态或液态
B.平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1
C.若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ
D.保持体积不变,向平衡体系中加入A,平衡向正反应方向移动
难度: 简单查看答案及解析

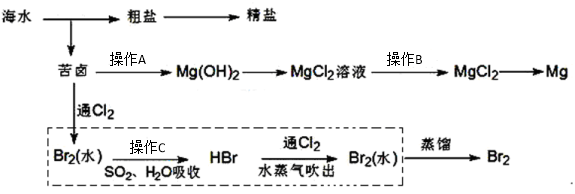
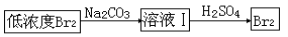 替代,请将Br2与Na2CO3反应的化学方程式补充完整并配平
替代,请将Br2与Na2CO3反应的化学方程式补充完整并配平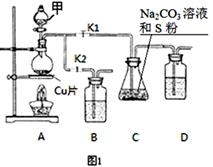
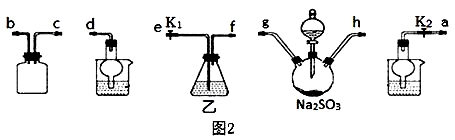
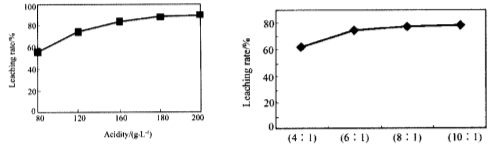


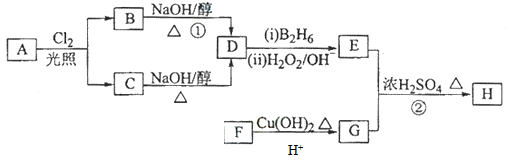
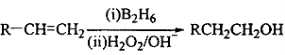
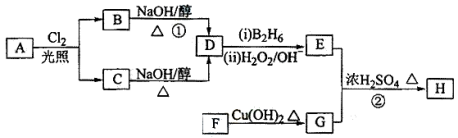 已知:
已知: