-
将纯水加热至较高温度,下列叙述正确的是
A. 水的离子积变大、pH变小、呈酸性 B. 水的离子积变大、pH变小、呈中性
C. 水的离子积变小、pH变大、呈碱性 D. 水的离了积不变、pH变小、呈中性
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)的溶液
C.由强酸、强碱等物质的量反应得到的溶液 D.非电解质溶于水得到的溶液
难度: 中等查看答案及解析
-
在25ºC时,在0.01mol·L-1的盐酸溶液中,水电离出的H+浓度是
A.5×10-13mol·L-1 B.0.02mol·L-1
C.1×10-7mol·L-1 D.1×10-12mol·L-1
难度: 简单查看答案及解析
-
下列关于水的电离平衡的相关说法正确的是
A.c(H+)=
的溶液一定呈中性
B.将水加热,Kw增大,pH增大,呈碱性
C.向水中加入少量硫酸氢钠固体,溶液的c(H+)增大,平衡逆向移动,Kw减小
D.向0.1 mol·L-1醋酸溶液中加水,溶液中水电离产生的c(H+)将减小
难度: 中等查看答案及解析
-
25 ℃,某稀溶液中由水电离产生的c(H+)为1×10-10 mol·L-1,下列说法正确的是( )
A.该溶液的pH不可能是7 B.该溶液不可能存在
C.该溶液的pH一定是10 D.该溶液的pH一定是4
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.100 ℃纯水的pH=6,所以水在100 ℃时呈酸性
B.pH=3的盐酸溶液,稀释至10倍后pH>4
C.0.2 mol·L-1的醋酸,与等体积水混合后pH=1
D.常温时,pH=3的盐酸与pH=11的氢氧化钠等体积混合后pH=7
难度: 简单查看答案及解析
-
25 ℃时,若pH=a的10体积某强酸溶液与pH=b的1体积某强碱溶液混合后溶液呈中性,则混合之前该强酸的pH与强碱的pH之间应满足的关系为
A.a+b=14 B.a+b=13
C.a+b=15 D.a+b=7
难度: 中等查看答案及解析
-
下列有关pH的计算一定正确的是
①pH=a的强酸溶液,加水稀释10n倍,则pH=a+n
②pH=a的弱酸溶液,加水稀释10n倍,则pH<a+n(a+n<7)
③pH=b的强碱溶液,加水稀释10n倍,则pH=b−n
④pH=b的弱碱溶液,加水稀释10n倍,则pH>b−n(b−n>7)
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
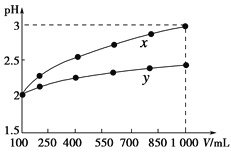
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
难度: 中等查看答案及解析
-
下列各式中属于正确的水解方程式的是( )
A.NH4++H2O
NH3·H2O+H+
B.S2-+2H2O
H2S+2OH-
C.CH3COOH+H2O
CH3COO-+H3O+
D.CH3COOH+OH-===CH3COO-+H2O
难度: 简单查看答案及解析
-
下列关于盐类水解的叙述中,错误的是
A.盐类水解是中和反应的逆反应
B.盐类水解过程中吸热过程
C.含有弱酸根盐的水溶液一定显碱性
D.盐溶液的酸碱性主要取决于形成盐的酸和碱的相对强弱
难度: 中等查看答案及解析
-
常温下用pH为3的某酸溶液分别与pH均为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的表述正确的是
A.b只能显碱性 B.a可能显酸性或碱性
C.a不可能显酸性 D.b可能显碱性或酸性
难度: 中等查看答案及解析
-
相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为
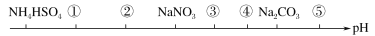
A. NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH
B. (NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH
C. (NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3
D. CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
难度: 简单查看答案及解析
-
已知某一温度下,0.1mol·L-1的NaHA强电解质溶液中,c(H+)<c(OH-)。则下列关系一定不正确的是( )
A.c(Na+)=c(HA-)+2c(A2-)+c(OH-)
B.c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
C.将上述溶液稀释至0.01mol/L,c(H+)·c(OH-)不变
D.c(A2-)+c(OH-)=c(H+)+c(H2A)
难度: 中等查看答案及解析
-
25 ℃时,在1.0 L浓度均为0.01 mol·L-1的某一元酸HA与其钠盐组成的混合溶液中,测得c(Na+)>c(A-),则下列描述中不正确的是( )
A.该溶液的pH<7
B.HA的酸性很弱,A-的水解程度较大
C.c(A-)+c(HA)=0.02 mol·L-1
D.n(A-)+n(OH-)=0.01 mol+n(H+)
难度: 中等查看答案及解析
-
在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的是 ( )
A. 加入适量纯CH3COOH
B. 加入少量NaCl固体
C. 加入少量NaOH固体
D. 加水稀释
难度: 中等查看答案及解析
-
同时对农作物施用含N、P、K的三种化肥,给定下列化肥:①K2CO3、②KCl、③Ca(H2PO4)2、④(NH4)2SO4、⑤NH3·H2O。其中最合理的组合方式是( )
A. ①③④ B. ②③④ C. ①③⑤ D. ②③⑤
难度: 中等查看答案及解析
-
下列溶液,在空气中受热浓缩,能够得到预想的无水盐的是
A.MgSO4溶液→MgSO4
B.FeCl3溶液→FeCl3
C.Mg(NO3)2溶液→Mg(NO3)2
D.AlCl3溶液→AlCl3
难度: 中等查看答案及解析