-
向沸水中滴加几滴饱和氯化铁溶液并继续煮沸至溶液呈红褐色时停止加热,此时当一束平行光线通过该红褐色液体时,从侧面可观察到一条光亮的“通路”。说明该红褐色液体是( )
A. 溶液 B. 胶体 C. 悬浊液 D. 乳浊液
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是 ( )
A.漂白粉有效成分的化学式:CaClO
B.Na+的结构示意图:
C.氯气与碘化钾溶液反应的化学方程式:Cl2+2KI=I2+2KCl
D.NaHCO3在水溶液中的电离方程式:NaHCO3=Na++H++
难度: 中等查看答案及解析
-
化学在生活中有着广泛的应用,下列对应关系不正确的是( )
A
铁粉具有还原性
袋装食品的抗氧剂
B
铁离子的氧化性比铜离子强
FeCl3溶液腐蚀Cu刻制印刷电路板
C
Na2O2能与CO2反应生成氧气
呼吸面具中的氧气来源
D
氯气具有漂白性
豆芽菜、银耳等食品的漂白
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在酸性无色溶液中,下列离子组能大量共存的是( )
A.Na+、Fe2+、
、Cl- B.Na+、Cu2+ 、
、
C.Ca2+、Mg2+、
、Cl- D.Ca2+、
、
、K+
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.硫酸和氢氧化钡溶液反应:Ba2++
=BaSO4↓
B.AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
C.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
D.少量稀盐酸滴入Na2CO3稀溶液中:
+H+=
难度: 中等查看答案及解析
-
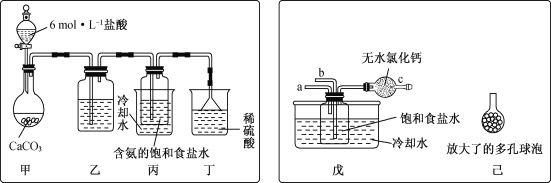
下列有关实验装置或操作进行的相应实验,能达到实验目的的是( )
A.用图
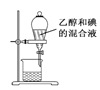 所示装置分离乙醇和碘的混合液
所示装置分离乙醇和碘的混合液B.用图
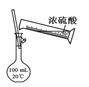 所示操作配制100 mL 0.1 mol·L-1硫酸溶液
所示操作配制100 mL 0.1 mol·L-1硫酸溶液C.用图
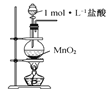 所示装置制取氯气
所示装置制取氯气D.用图
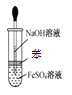 所示装置不能制取Fe(OH)2
所示装置不能制取Fe(OH)2难度: 中等查看答案及解析
-
4018Ar、4019K、4020Ca三种原子,它们具有相同的( )
A.质子数 B.中子数 C.质量数 D.电子数
难度: 简单查看答案及解析
-
下列实验结论正确的是( )
A.向某溶液中加入酚酞,溶液不变色,则该溶液一定显酸性
B.向某溶液中加入氯化钡溶液产生白色沉淀,再加入盐酸沉淀不消失,则该溶液中一定有
C.向某溶液中加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有
D.向某溶液中滴加KSCN试剂,溶液变成血红色,则该溶液中一定有Fe3+
难度: 中等查看答案及解析
-
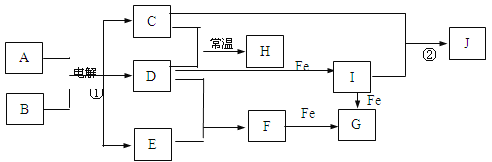
根据下图海水综合利用的工艺流程图,判断下列说法正确的是 ( )
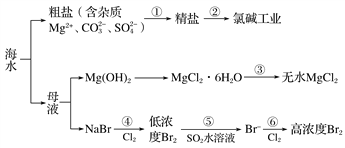
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A. 过程①的提纯是物理过程
B. 在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 工业上采用向母液中加入烧碱的方法获得氢氧化镁
难度: 中等查看答案及解析
-
氯仿(CHCl3,非电解质)在空气中能发生缓慢氧化,生成剧毒物质光气(COCl2,非电解质),化学方程式为2CHCl3+O2=2COCl2+2HCl。检验氯仿是否被氧化应选用的试剂是( )
A.水 B.NaOH溶液
C.酚酞溶液 D.硝酸酸化的硝酸银溶液
难度: 简单查看答案及解析
-
高铁酸钾K2FeO4是一种高效、氧化性比Cl2更强的水处理剂,工业上常用下列反应先制高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在低温下,在Na2FeO4溶液中加KOH固体至饱和就可析出K2FeO4,下列有关说法不正确的是( )
A.Na2O2在反应中作氧化剂,又作还原剂
B.高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小
C.K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物
D.制取高铁酸钠时,每生成1molNa2FeO4反应中共有4mol电子转移
难度: 困难查看答案及解析
-
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A.M B.M2+ C.M3+ D.MO2+
难度: 中等查看答案及解析