-
现有四种元素的基态原子的电子排布式如下:① [Ne]3s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A. 最高正化合价:③>②>① B. 原子半径:③>②>①
C. 电负性:③>②>① D. 第一电离能:③>②>①
难度: 简单查看答案及解析
-
下列现象不能用“相似相溶”解释的是( )
A. 氯气易溶于NaOH溶液 B. 用CCl4 萃取碘水中的碘
C. 二氧化硫易溶于水 D. 苯与水混合静置后分层
难度: 中等查看答案及解析
-
下列化学用语的理解正确的是( )
A.Cr的价电子排布式为3d44s2
B.氢氧根离子的电子式为
C.1s22s22p3 和 1s22s22p4 能形成AB2型共价化合物
D.比例模型为
可以同时表示CH4和CCl4分子
难度: 中等查看答案及解析
-
具有下列电子排布式的原子中,半径最大的是( )
A.1s22s22p63s23p1 B.1s22s22p3 C.1s22s22p2 D.1s22s22p63s23p4
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.某价电子排布为3d14s2 的 基态原子,该元素位于周期表中第四周期第ⅢB族
B.在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C.某基态原子的核外电子排布图为
 , 它违背了泡利原理
, 它违背了泡利原理D.Xe元素的所在族的原子的价电子排布式均为ns2np6,属于非金属元素
难度: 中等查看答案及解析
-
下表代表周期表中的几种短周期元素,下列说法中错误的是

A.ED4分子中各原子均达8电子结构
B.AD3和ED4两分子的中心原子均为sp3杂化
C.A、B、C第一电离能的大小顺序为C>B>A
D.C、D气态氢化物稳定性强弱和沸点高低均为C>D
难度: 中等查看答案及解析
-
下列说法中正确的是
A.焰色反应是化学变化
B.基态碳原子的电子排布式是1s22s12p3
C.焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D.同一原子处于激发态时的能量一定大于其处于基态时的能量
难度: 简单查看答案及解析
-
下列分子中,既含有σ键,又含有π键的是( )
A.CH4 B.HCl C.CH2===CH2 D.F2
难度: 简单查看答案及解析
-
下列分子或离子的立体结构,其中不正确的是( )
A.NH4+ 为正四面体形 B.CS2为直线形
C.HCN为角形(V形) D.PCl3为三角锥形
难度: 中等查看答案及解析
-
下列化合物中含有手性碳原子的是( )
A.
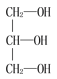 B.
B.C.CCl2F2 D.H2N-CH2-COOH
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.P4和CH4都是正四面体分子且键角都为109o28ˊ
B.H2O是一种非常稳定的化合物,这是由于氢键所致
C.NO3-和CO32-是等电子体,均为平面正三角形结构
D.金属晶体与熔融态的离子晶体导电都是物理变化
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A.124g P4含有的P-P键的个数为6NA
B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA
D.60gSiO2中含Si-O键的个数为2NA
难度: 中等查看答案及解析
-
元素周期表中, 某些主族元素与右下方的主族元素的性质具相似性, 这种规律被称为“对角线规则”。 下列叙述不正确的是
A.Li在N2中燃烧生成Li3N B.Li在空气中燃烧生成Li2O2
C.可用NaOH 溶液分离 Mg(OH)2和Be(OH)2 D.硼酸钠溶液显碱性
难度: 中等查看答案及解析
-
关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是
A.配位体是Cl﹣和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl﹣的数目比是1:2
D.加入足量AgNO3溶液,所有Cl﹣均被完全沉淀
难度: 中等查看答案及解析
-
某离子晶体的晶胞结构如下图所示:
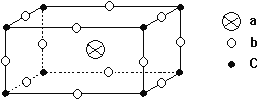
则该离子晶体的化学式为
A.abc B.abc3 C.ab2c3 D.ab3c
难度: 简单查看答案及解析
-
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的气态氢化物相对分子质量依次减小,所以其稳定性依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素X、W和M的可形成组成为XWM的强氧化剂
难度: 中等查看答案及解析
-
离子键、共价键、金属键、范德华力都是微粒之间的不同作用力,下列物质:①Na2O2②SiO2③氦气 ④金刚石 ⑤NH4Cl ⑥白磷 含有上述任意两种作用力的是( )
A.①②④ B.①③⑥ C.①⑤⑥ D.③④⑤
难度: 中等查看答案及解析
-
已知NaCl的摩尔质量为58.5g·mol-1,其晶体密度为dg·cm-3,若图中钠离子与最接近的氯离子的核间距离为acm,那么阿伏加德罗常数的值可表示为( )。
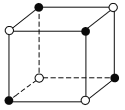
A.117a3d B.
C.
D.
难度: 中等查看答案及解析
-
下面的排序不正确的是 ( )
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
难度: 中等查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
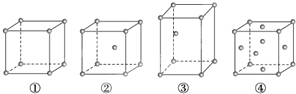
A. ①为简单立方堆积,②为镁型,③为钾型,④为铜型
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
难度: 中等查看答案及解析
-
关于下列几种离子晶体,说法不正确的是( )
A.由于NaCl晶体和CsCl晶体中正负离子半径比不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4,配位数不相等主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高,主要是因为MgO的晶格能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
难度: 中等查看答案及解析
-
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构的分析中正确的是
A.K3C60中既有离子键,又有极性键
B.1 molK3C60中含有的离子数目为63×6.02×1023
C.该晶体在熔融状态下不能导电
D.该物质的化学式可写为KC20
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.原子晶体中共价键越强,熔点越高
B.在卤族元素(F、Cl、Br、I)的氢化物中,HCl的沸点最低
C.CaH2、Na2O2晶体的阴、阳离子个数比分别为2∶1、1∶1
D.晶体熔点:金刚石>食盐>冰>干冰
难度: 中等查看答案及解析
-
元素周期律揭示了元素间的递变规律,下列递变规律正确的是( )
A.ⅣA族元素氢化物沸点:SiH4>CH4,所以ⅤA族元素氢化物沸点:PH3>NH3
B.第二周期元素氢化物稳定性:HF>H2O,第三周期元素氢化物稳定性:HCl>H2S
C.ⅦA族元素的非金属性:F>Cl,所以ⅦA族元素氢化物的酸性:HF<HCl
D.镁比铝活泼,工业上用电解熔融氧化铝制铝,所以工业上也用电解熔融氧化镁制镁
难度: 中等查看答案及解析