-
(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+ 2KNO3+ 3C 3CO2↑+ A + N2↑(已配平)
3CO2↑+ A + N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为__________。
②生成物A的晶体类型为__________,含极性共价键的分子的中心原子轨道杂化类型为_______。
③已知CN-与N2结构相似,推算HCN分子中 键与
键与 键数目之比为____________。
键数目之比为____________。
(2)GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是_________。
(3)下列有关说法正确的是______________。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.铬的堆积方式与钾相同,则其堆积方式如图

D.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
(4)含有Cu2+ 的溶液中加入过量氨水,发现生成深蓝色溶液,试写出反应的离子方程式:_______。
(5)氮化硼形成立方晶体,晶体结构类似金刚石,如图所示。

已知:该晶体密度为ρg·㎝-3,NA代表阿伏加德罗常数的值。
①该晶体的化学式为______________。
②在该晶体中,B与N形成共价键的键长(d)为________________________pm(列式即可)。
-
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3 + 3C+S A + N2↑+ 3CO2↑(已配平)
A + N2↑+ 3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为_________。
②在生成物中,A的电子式________,含极性共价键的分子的中心原子轨道杂化类型为_____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为________,Q2+的未成对电子数是__________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+,交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 ml,可知该配离子的化学式为_______。
-
(1)中国古代四大发明之一一黑火火药,它的爆炸反应为;S+2KNO3+3C  3CO2↑+A+N2↑(已配平)
3CO2↑+A+N2↑(已配平)
①除S外,上列元素的电负性从大到小依次为______.
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_______.
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为_________.
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是________.
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)]6-nx+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)]6-nx++xR-H→Rx[CrCln(H2O)]6-n+xH+交换出来的H+经中和测定,即可求出x和n,确定配离子的组成。将含0.0015mol[CrCln(H2O)]6-nx+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200mol▪L-1NaOH溶液25.00mL,该配离子的化学式为______.
-
(14分)(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
②除S外,上列元素的电负性从大到小依次为 。
(2)①已知CN—与N2结构相似,推算HCN分子中 键与
键与 键数目之比为 。
键数目之比为 。
②原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,Q2+的未成对电子数是 。
③在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。 将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,该配离子的化学式为 。
-
Ⅰ.黑火药是中国古代四大发明之一,已知它在爆炸时发生反应的化学方程式为:
S+2KNO3+3C==A+N2↑+3CO2↑(已配平,A特指某一晶体);请回答下列问题:
(1)S外,上述元素的电负性从大到小依次为________________(填写元素符号)。
(2)在生成物中,A的晶体类型为__________,含极性共价键的分子内的中心原子轨道杂化类型为。
(3)已知CN-与N2为等电子体,推算HCN分子中σ键与π键数目之比为___________。
Ⅱ.原子序数小于36的元素E和G,在周期表中既处于同一周期又位于同一族,且原子序数G比E多2。则G元素的基态原子外围电子(价电子)排布式为;E3+离子的核外未成对电子数是___________。
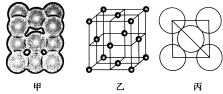
Ⅲ.若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为;该晶胞的空间利用率为________________。该单质晶体中原子的堆积方式为四种基本堆积方式中的____________。
Ⅳ.在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR—HRx [CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。现将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00mL,可知该配离子的化学式为,中心离子的配位数为_________。
[CrCln(H2O)6﹣n]+xH+;交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。现将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200mol·L-1NaOH溶液25.00mL,可知该配离子的化学式为,中心离子的配位数为_________。
-
(1)中国古代四大发明之一黑火药,它的爆炸反应为2KNO3+3C+S =A + N2↑ +3CO2↑(已配平)
①除S外,上述反应中所涉及到的非金属元素的电负性从大到小顺序依次为_____________, K2O,CO2,SO2,SiO2四种晶体的熔点由高到低的顺序______________________
②生成物A的电子式为_____________。
推算HCN分子中 键与
键与 键数目之比为_______________。
键数目之比为_______________。
(2) 原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多 2。T在元素周期表中的位置为__________________,1molQ2+的未成对电子数是__________个。
(3)在 的水溶液中,一定条件下存在组成为
的水溶液中,一定条件下存在组成为 (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x+ + xR-H = Rx[CrCln (H2O)6-n] + xH+
交换出来的H+经中和滴定,即可求出x和n,从而确定配离子的组成。
将含0.0015 mol  的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
的溶液,与R-H完全交换后,中和交换过程中生成的H+需浓度为0.1200 mol·L-1 的NaOH溶液25.00 ml,则该配离子的化学式为_________________________。
-
(7分)(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
-
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)。
A+N2↑+3CO2↑(已配平)。
①除 S 外,上列元素的电负性从大到小依次为____________________;
②生成物中,A 的电子式为______,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
-
中国古代四大发明之一黑火药,它的爆炸反应为:S +2KNO3+3C ﹦ A+N2↑+3CO2↑(已配平)
(1)除S外,上述元素的电负性从小到大依次为_______。除K、S外第一电离能从大到小的顺序为______________。
(2)在生成物中,A为______化合物,CO2为_______化合物(填“离子化合物”或共价化合物),含极性共价键的分子的中心原子轨道杂化类型为______________。
(3)CN﹣与N2互为______,写出CN﹣的电子式________。推算HCN分子中σ键与π键数目之比_________
-
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上述元素的电负性从大到小依次为________;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为_______, A的晶体类型为____________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为________________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为__________,Q2+的未成对电子数是____________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R—H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR—H―→Rx[CrCln(H2O)6-n]+xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015 mol [CrCln(H2O)6-n]x+的溶液,与R—H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00 mL,可知该配离子的化学式为________。
3CO2↑+ A + N2↑(已配平)
键与
键数目之比为____________。


