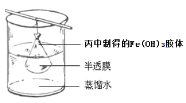
-
下列物质的变化不能产生自由移动离子的是( )
A.醋酸(CH3COOH)溶于水 B.氯化氢通入水中
C.氧化钙固体受热熔化 D.蔗糖溶于水
难度: 简单查看答案及解析
-
下图为一“铁链”图案,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号,其分类依据代号判断不正确的是( )
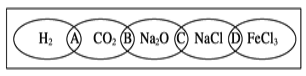
A.代号A都不是电解质 B.代号B因其水溶液都能导电都是电解质
C.代号C都是钠的化合物 D.代号D因其组成都是金属氯化物
难度: 简单查看答案及解析
-
以下电离方程式正确的是( )
A.NaHCO3=Na++HCO32- B.K2SO4=K++
C.Ca(OH)2=Ca2++OH2- D.NaHSO4=Na++H++
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①由一种元素组成的物质一定是纯净物 ②冰水混合物是纯净物 ③CuSO4·5H2O晶体是混合物④能电离出H+的物质是酸 ⑤酸性氧化物一定是非金属氧化物;非金属氧化物不一定是酸性氧化物⑥碱性氧化物一定是金属氧化物;金属氧化物不一定是碱性氧化物
A.①和④ B.②和⑥ C.③和④ D.全部
难度: 中等查看答案及解析
-
在10﹣9m~l0﹣7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化。纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸,下列说法正确的是( )
A.纳米铜是一种新型胶体
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无需密封保存
难度: 中等查看答案及解析
-
下列反应的离子方程式错误的是( )
A.碳酸钙和稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B.硫酸铵溶液与氢氧化钡溶液反应:SO42- + Ba2+ = BaSO4↓
C.CO2通入足量澄清石灰水中:CO2+Ca2++2OH﹣=CaCO3↓+H2O
D.CuO与硝酸反应:CuO+2H+=Cu2++H2O
难度: 中等查看答案及解析
-
氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
难度: 简单查看答案及解析
-
在某无色酸性溶液中能大量共存的一组离子是( )
A.Na+、K+、
、
B.
、
、Al3+、
C.Na+、Ca2+、
、
D.K+、
、
、
难度: 中等查看答案及解析
-
关于如下反应:HgS+O2
Hg+SO2,下列叙述正确的是
A. 该反应既是置换反应又是离子反应 B. 该反应转移了2e –
C. Hg是氧化产物 D. HgS既是还原剂又是氧化剂
难度: 中等查看答案及解析
-
下列各组在溶液中的反应,不管反应物的量是多少,都能用同一离子方程式表示的是( )
A.NaOH与CO2 B.Ba(OH)2与H2SO4
C.HCl与Na2CO3 D.NaHSO4与Ba(OH)2
难度: 中等查看答案及解析
-
下列①~④是钠与水反应的实验现象、解释和结论,其中对应关系不正确的是( )
序号
实验现象
解释和结论
A
钠浮在水面上
钠的密度比水小
B
钠熔成小球
钠与水反应放热且钠的熔点低
C
钠四处游动,嘶嘶作响
生成了水蒸气
D
向反应后的溶液中滴加酚酞,溶液变红
生成了碱性物质
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个反应:SO2+2Fe3++2H2O == SO42-+4H++2Fe2+,Cr2O72-+6Fe2++14H+ == 2Cr3++6Fe3++7H2O。下列说法正确的是( )
A.Cr2O72-不能将SO2氧化 B.还原性:Cr3+>Fe2+>SO2
C.氧化性:Cr2O72->Fe3+>SO2 D.两个反应中Fe3+均表现还原性
难度: 中等查看答案及解析
-
下列化学反应中电子转移的表示方法正确的是 ( )
A.
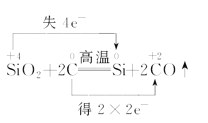
B.
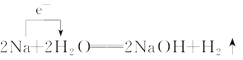
C.
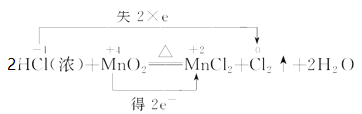
D.

难度: 中等查看答案及解析
-
镁粉加入到很稀的硝酸中发生反应:4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O在该反应中被还原的硝酸和未被还原的硝酸的物质的量比为 ( )
A.4:10 B.1:9 C.1:5 D.1:7
难度: 中等查看答案及解析
-
钠、镁、铝各
分别放入
的盐酸中,同温同压下产生的气体体积之比是( )
A.1:2:3 B.3:2:1 C.3:1:1 D.1:1:1
难度: 中等查看答案及解析
-
若mg Na在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mg Na与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g ④(m+1.6)g ⑤(m+1.4)g
A.仅①④ B.仅①⑤ C.仅③④ D.①②③④⑤
难度: 中等查看答案及解析
-
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1∶3 B.4∶3 C.2∶1 D.3∶1
难度: 中等查看答案及解析
-
离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知Ca2+、OH-、
的摩尔电导率分别为0.60、1.98、0.45据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A.
 B.
B.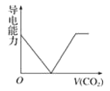 C.
C. D.
D.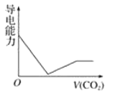
难度: 中等查看答案及解析
-
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100 mL,已知溶液中阳离子的浓度相等(不考虑水解),且
的物质的量浓度为9 mol·L-1,则此溶液最多溶解Mg的质量为( )
A.24 g B.18 g C.21.6 g D.14.4 g
难度: 中等查看答案及解析
-
已知某强氧化剂
中的R元素被Na2SO3还原到较低价态。如果还原2.4×10-3mol
至较低价态,需要60 mL 0.1 mol·L-1的Na2SO3溶液。那么,R元素被还原成的价态是
A. -1 B. 0 C. +1 D. +2
难度: 中等查看答案及解析