-
某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A. 配合物中中心原子的电荷数和配位数均为6
B. 该配合物可能是平面正方形结构
C. Cl-和NH3分子均与Pt4+配位
D. 配合物中Cl-与Pt4+配位,而NH3分子不配位
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm−(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是
①a-b=n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y ⑤离子半径r(Rm−)>r(Zn−)>r(Yn+)>r(Xm+)
A. ②③⑤正确 B. 只有③正确 C. ①②③④正确 D. ①②③正确
难度: 中等查看答案及解析
-
下列能级符号正确的是
A. 6s B. 2d C. 3f D. 1p
难度: 简单查看答案及解析
-
在核电荷数为26的元素Fe的基态原子核外的3d、4s轨道内,下列电子排布图正确的是
A.
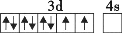 B.
B. 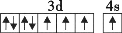
C.
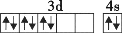 D.
D. 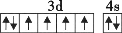
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A. 次氯酸的电子式:
B. Mg原子的结构示意图:
C. 硫化钠的电子式:
D. Fe2+基态核外价电子排布式为:3d6
难度: 简单查看答案及解析
-
下列物质中,既含有极性键又含有非极性键的非极性分子是
A. Na2O2 B. HCHO C. C2H4 D. H2O2
难度: 简单查看答案及解析
-
甲醛(
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键 B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子 D. 甲醇的沸点远低于甲醛的沸点
难度: 简单查看答案及解析
-
下列分子或离子中键角由大到小排列顺序是
①BF3 ②NCl3 ③H2O ④NH4+ ⑤BeCl2
A. ⑤④①②③ B. ⑤①④②③ C. ④①②⑤③ D. ③②④①⑤
难度: 中等查看答案及解析
-
下列分子中,所有原子都满足最外层为8电子结构的是
A. BF3 B. PCl5 C. HCl D. CF2Cl2
难度: 简单查看答案及解析
-
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”.该元素的名称是为了纪念天文学家哥白尼而得名.该中心人工合成Cn的过程可表示为:
Zn+
═
Cn +
下列叙述中正确的是
A. 上述合成过程中属于化学变化
B. Cn元素的相对原子质量为277
C.
Cn的原子核内中子数比质子数多53
D. Cn元素位于元素周期表的第六周期,是副族元素
难度: 中等查看答案及解析
-
下列说法正确的是
A. 最后一个电子排在s能级的元素不一定处于周期表的s区
B. 同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1
C. 相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D. 主族序数等于周期序数的元素一定为金属元素
难度: 简单查看答案及解析
-
下列有关物质性质的比较正确的是
①同主族元素的单质从上到下,氧化性逐渐减弱,熔点逐渐升高
②元素的非金属性越强,气态氢化物的热稳定性越弱
③单质与水反应的剧烈程度:F2>Cl2>Br2>I2
④元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑤还原性:S2->Se2-
⑥酸性:HNO3>H3PO4
A. ①③ B. ②④ C. ③⑥ D. ⑤⑥
难度: 中等查看答案及解析
-
下列对分子的性质的解释中,不正确的是
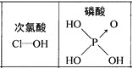
A. 水很稳定(1000℃以上才会部分分解),但与水中含有大量氢键无关
B. [Cu(NH3)4]SO4和(NH4)2SO4两种物质中都有配位键,所以都是配合物
C. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
D. 由如图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
难度: 中等查看答案及解析
-
根据等电子原理判断,下列说法中错误的是
A. B3N3H6和苯是等电子体,分子中所有原子均在同一平面上
B. N2O与SiO2为等电子体、具有相似的结构(包括电子式)
C. H3O+和NH3是等电子体,均为三角锥形
D. CH4和NH4+是等电子体,均为正四面体结构
难度: 中等查看答案及解析
-
前中国科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成化合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且其结构也没有发生改变,得到了可供衍射实验的单晶体。下列说法中不正确的是
A. H2NCONH2与H2O2是通过氢键结合的 B. H2O2分子中只含σ键,不含π键
C. H2NCONH2中σ键与π键的数目之比为7:1 D. H2NCONH2·H2O2属于离子化合物
难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2表示,单位为kJ/mol)。
I1
I2
I3
I4
……
R
740
1500
7700
10500
……
下列关于元素R的判断中一定正确的是
A. R的最高正价为+1价
B. R元素的第一电离能比同周期相邻元素的第一电离能都大
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
难度: 中等查看答案及解析
-
根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是
元素代号
A
B
C
D
E
原子半径/nm
0.186
0.143
0.089
0.104
0.074
主要化合价
+1
+3
+2
+6、-2
-2
A. E2-与B3+的核外电子数不可能相等 B. 离子半径大小A+<D2-
C. 最高价氧化物对应水化物的碱性A<C D. 氢化物的稳定性D>E
难度: 困难查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A. 常温常压下X的单质为气态 B. W与Y具有相同的最高化合价
C. Y和Z形成的化合物的水溶液呈碱性 D. Z的氢化物为离子化合物
难度: 中等查看答案及解析