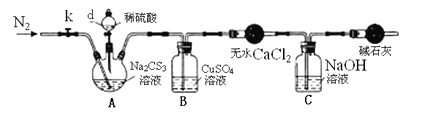
-
中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
难度: 简单查看答案及解析
-
分类是科学研究的重要方法,下列物质分类不正确的是
A. 化合物:干冰、冰水混合物、烧碱
B. 同素异形体:活性炭、C60、金刚石
C. 非电解质:乙醇、四氯化碳、氯气
D. 混合物:漂白粉、纯净矿泉水、盐酸
难度: 中等查看答案及解析
-
下列说法正确的是
①非金属氧化物一定不是碱性氧化物 ②电解质溶液的导电过程伴随化学变化
③HCl既有氧化性又有还原性 ④Fe(OH)3、FeCl3、HNO3都不能用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
A. ②⑤ B. ①②③④ C. ①②③ D. ①②③⑤
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是:
A. 23 g Na与氧气充分燃烧,生成Na2O和Na2O2的混合物,转移的电子数为大于NA小于2NA
B. 1 mol甲醇中含有的共价键数为5NA
C. 标准状况下22.4L C6H6充分燃烧消耗氧气7.5 NA
D. 0.2mol/L的Na2SO4溶液中含Na+ 数为0.4NA
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1molAlCl3在熔融状态时含有的离子总数为4NA
B.某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
C.8.7g二氧化锰与含有0.4molHCl的浓盐酸加热充分反应,转移电子的数目为0.2NA
D.12g金刚石中C-C键的数目为4NA
难度: 中等查看答案及解析
-
利用图所示装置进行下列实验,能得出相应实验结论的是
选项
①
②
③
实验结论
A
稀盐酸
CaCO3
Na2SiO3溶液
非金属性:Cl>C>Si
B
浓硫酸
蔗糖
Ba(NO3)2溶液
验证SO2与可溶性钡盐可生成白色沉淀
C
浓氨水
生石灰
酚酞溶液
氨气的水溶液呈碱性
D
浓硝酸
Fe
NaOH溶液
铁和浓硝酸反应可生成NO2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
C.氧化铜与稀硫酸反应:2H++O2-=H2O
D.碳酸氢钠溶液中加入盐酸:CO32-+2H+=CO2↑+H2O
难度: 中等查看答案及解析
-
某无色透明的溶液,在c(H+)水=1×10-13的条件下都能大量共存的是( )
A.Fe2+ K+ SO42- NO3- B.Mg2+ NH4+ SO42- Cl-
C.Ba2+ Na+ MnO4- SO42- D.Na+ K+ SO42- NO3-
难度: 中等查看答案及解析
-
安全气囊碰撞时发生反应:10NaN3+2KNO3===K2O+5Na2O+16N2↑,下列判断正确的是( )
A.每生成16 mol N2转移30 mol电子
B.NaN3中N元素被还原
C.N2既是氧化剂又是还原剂
D.还原产物与氧化产物质量之比为1∶15
难度: 中等查看答案及解析
-
测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的实验方案不合理的是( )
A.取ag混合物用酒精灯充分加热后质量减少bg
B.取ag混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收后质量增加bg
C.取ag混合物与足量氢氧化钡溶液充分反应,过滤、洗涤、烘干,得bg固体
D.取ag混合物于锥形瓶中加水溶解,滴入1~2滴酚酞指示剂,用标准盐酸溶液滴定至终点,消耗盐酸VmL
难度: 困难查看答案及解析
-
探究Na2O2与水的反应,实验如图:(已知:H2O2
H+ + HO2-、HO2-
H+ + O22-)下列分析不正确的是
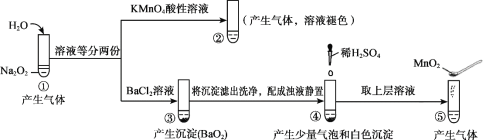
A.①、⑤中产生的气体能使带火星的木条复燃
B.①、④中均发生了氧化还原反应和复分解反应
C.②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D.通过③能比较酸性:HCl>H2O2
难度: 中等查看答案及解析
-
下列实验中的颜色变化,与氧化还原反应无关的是
A
B
C
D
实验
新制氯水滴入Na2S 溶液中
乙醇滴入K2Cr2O7酸性溶液中
饱和FeCl3溶液滴入沸水中
草酸滴入KMnO4 酸性溶液中
现象
产生黄色浑浊
溶液由橙色变为绿色
液体变为红褐色且澄清透明
产生无色气体,溶液紫红色褪去
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:①H2(g)+
O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1;
②H2(g)+
O2(g)=H2O(l) ΔH2=-285.8kJ·mol-1。
气态分子中的化学键
断开1mol化学键所需的能量/kJ
O—H
465
O=O
498
下列说法不正确的是( )
A.氢气的燃烧热ΔH=-241.8kJ·mol-1
B.断开1molH—H键需要吸收439.2kJ的能量
C.相同条件下,1molH2O(g)比1molH2O(l)能量高
D.18gH2O(l)完全分解生成氢气和氧气,需要吸收285.8kJ的能量
难度: 中等查看答案及解析
-
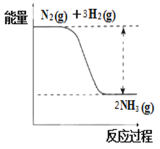
能说明在固定的密闭容器中进行的反应:3H2(g)+N2(g) ⇌ 2NH3(g) 已经达到平衡的是:
A. c(H2):c(N2):c(NH3)=3:1:2 B. 容器内气体的密度不再改变
C. 容器内气体的平均摩尔质量不变 D. 氢气消耗的速率是氮气消耗速率的3倍
难度: 简单查看答案及解析
-
在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是
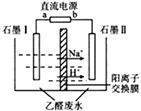
A.以铅蓄电池为电源,则a极为Pb电极
B.石墨Ⅱ电极附近的pH逐渐减小
C.阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+
D.每处理含8.8g乙醛的废水,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
500 mL KNO3和Cu(NO3)2的混合溶液中c(NO
)=0.6 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24 L气体(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
A.原混合溶液中c(K+)为0.2 mol·L-1
B.上述电解过程中共转移0.2 mol电子
C.电解得到的Cu的物质的量为0.05 mol
D.电解后溶液中c(H+)为0.2 mol·L-1
难度: 中等查看答案及解析