-
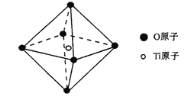
W、X、Y、Z都是元素周期表中前20号的元素.W的阳离子与Y的阴离子具有相同的电子层结构,且能形成化合物WY;Y和Z属同族元素,它们能形成两种常见化合物;X和Z属于同一周期元素,它们能形成两种常见气态化合物;W和X能形成化合物WX2,X和Y不在同一周期,它们能形成组成为XY2的化合物.关于W、X、Y、Z的说法正确的是( )
A. 气态氢化物稳定性:X>Z B. 最高价氧化物对应的水化物酸性:X<Y
C. 化合物WX2和XY2均为共价化合物 D. W、Y、Z的简单离子半径:W>Y>Z
难度: 困难查看答案及解析
-
2018年是“2025中国制造”启动年,而化学与生活、人类生产、社会可持续发展密切相关,下列有关化学知识的说法错误的是
A. 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
B. 我国发射“嫦娥三号”卫星所使用的碳纤维,是一种非金属材料
C. 用聚氯乙烯代替木材,生产快餐盒,以减少木材的使用
D. 碳纳米管表面积大,可用作新型储氢材料
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.中子数比质子数多1的磷原子:
B.Al3+的结构示意图:

C.次氯酸钠的电子式:
D.2-丁烯的结构简式:CH2=CH-CH=CH2
难度: 简单查看答案及解析
-
化学与生产、实验密切相关。下列有关物质的性质与用途具有对应关系的是( )
A.浓硫酸具有强氧化性,可用于干燥CO2
B.FeCl3溶液呈酸性,可用于腐蚀电路板上的Cu
C.碳酸钠溶液具有碱性,可用于治疗胃酸过多
D.Al2O3熔点高,可用作耐高温材料
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1Na2SO3溶液:Ba2+、K+、ClO-、OH-
B.0.1mol·L-1NaAlO2溶液:Na+、NH4+、H+、SO42-
C.0.1mol·L-1H2SO4溶液:Mg2+、K+、Cl-、NO3-
D.0.1mol·L-1Ba(OH)2溶液:NH4+、Na+、Cl-、HCO3-
难度: 中等查看答案及解析
-
下列有关化学反应的叙述正确的是( )
A.锌与稀硫酸反应时加入少量硫酸铜,反应加快的原因是Cu2+水解增大了H+浓度
B.室温下Na与空气中O2反应制取Na2O2
C.将过量氨气通入CuSO4溶液中可得深蓝色溶液
D.过量铁粉在氯气中燃烧可生成氯化亚铁
难度: 简单查看答案及解析
-
实验室将NH3通入AlCl3溶液中制备Al(OH)3,经过滤、洗涤、灼烧得Al2O3,下列图示装置和原理均能达到实验目的是( )
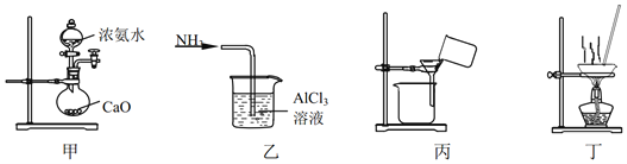
A.用装置甲制取NH3 B.用装置乙制备Al(OH)3
C.用装置丙过滤并洗涤Al(OH)3 D.用装置丁灼烧Al(OH)3得Al2O3
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能一步实现的是( )
A.Fe
Al
H2
B.Na
Na2O2
NaOH
C.MgCO3
MgCl2(aq)
Mg
D.N2(g)
NH3(g)
Na2CO3(s)
难度: 中等查看答案及解析
-
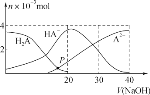
下列图示与对应的叙述符合的是( )
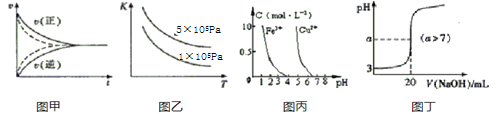
A.图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化
B.图乙表示反应2SO2(g)+O2(g)
2SO3(g)的平衡常数K与温度和压强的关系
C.据图丙,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH=4左右
D.图丁表示常温下向20mL0.001mol/L的醋酸溶液中滴加0.001mol/L的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
难度: 中等查看答案及解析
-
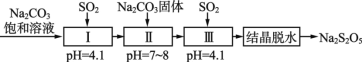
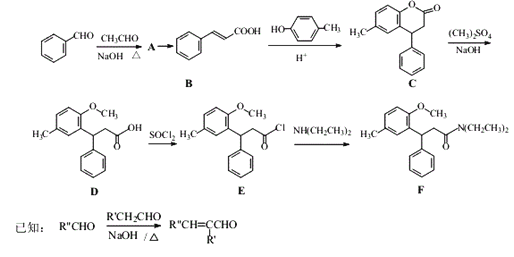
丁苯酞是一种治疗急性脑缺血的药物,部分合成流程如下。下列说法错误的是( )
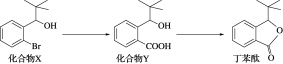
A.化合物X、Y和丁苯酞三种分子中各含有1个手性碳原子
B.化合物Y可以发生取代、氧化和还原反应
C.可用Na2CO3溶液鉴别化合物X和化合物Y
D.化合物X、Y和丁苯酞各1 mol最多消耗NaOH的量均为1 mol
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是( )
选项
操作和现象
结论
A
向碳酸钠溶液中加入浓盐酸,将反应后的气体通入苯酚钠溶液中,溶液变浑浊
酸性:碳酸>苯酚
B
淀粉KI溶液中通入Cl2,再通入SO2,溶液先出现蓝色,后蓝色褪去
还原性: SO2> I-> C1-
C
苯与液溴混合后加入Fe粉,通过导管将气体导入AgNO3溶液中,出现浑浊
苯与液溴发生取代反应
D
取5 mL 0.1 mol·L-1FeCl3溶液,滴加5滴0.1 mol·L-1KI溶液,振荡,再加入5 mL CCl4,振荡,静置,取上层液体,向其中滴加KSCN溶液,显血红色
KI和FeCl3反应有一定的限度
A.A B.B C.C D.D
难度: 困难查看答案及解析