-
我国首辆月球车“玉兔”号用
Pu作为热源材料。下列关于
Pu的说法正确的是( )
A.
Pu是金属元素 B.
Pu与
Pu互为同素异形体
C.
Pu与
U具有相同的化学性质 D.
Pu是第六周期元素
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是
A.过氧化钠的电子式:
B.氯原子的结构示意图:
C.中子数为76、质子数为55的原子
D.次氯酸的分子式:HClO;次氯酸的电子式:
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 干冰升华和液氯气化时,都只需克服分子间作用力
B. 氯化氢气体溶于水产生H+和Cl-,所以HCl是离子化合物
C. 硫酸氢钠晶体溶于水,需要克服离子键和共价键
D. 加热氯化铵固体使其分解,需克服离子键和共价键
难度: 简单查看答案及解析
-
碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,不正确的是( )
A. 在碱金属元素形成的单质中它熔点最低
B. 它的氢氧化物化学式为FrOH,是一种强碱
C. 钫在空气中燃烧时,只生成化学式为Fr2O的氧化物
D. 它能跟水反应,由于反应剧烈而发生爆炸
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 18 g H2O、D2O组成的物质中含有的质子数为10NA
B. 1 mol白磷分子(P4)中含有的P—P键的数目为6NA
C. 0.1molNaCl中含有0.1NA个NaCl分子
D. 在反应2Na2O2+CO2===2Na2CO3+O2↑中,每生成32g O2转移的电子数为NA
难度: 中等查看答案及解析
-
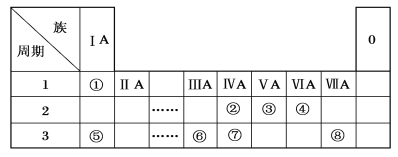
短周期元素A、B、C、D、E在周期表中的位置如图所示。下列说法中正确的组合是( )
A
B
C
D
E
①若A(OH)n为强碱,则B(OH)m也一定为强碱;
②若A(OH)n为两性氢氧化物,则D的最高价氧化物对应水化物可以与其简单氢化物反应;
③若HnCOm为强酸时,E的单质可能具有强氧化性;
④若HnEOm为强酸,A的氯化物一定是离子化合物。
A. ①④ B. ②④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是( )
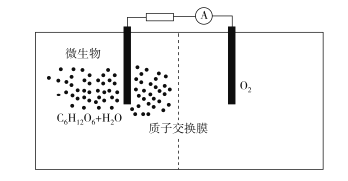
A. 负极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 正极反应式为O2+4e-+2H2O=4OH-
D. 电池总反应为C6H12O6+6O2===6CO2+6H2O
难度: 中等查看答案及解析
-
右图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A. 原子半径:Z>Y>X
B. 气态氢化物的还原性: R < W
C. WX3和水反应形成的化合物是共价化合物
D. 含Z的两种盐溶液反应的离子方程式是Z3++ZO2-+H2O=2Z(OH)3↓
难度: 中等查看答案及解析
-
A、B、C、D、E代表五种金属,有以下化学反应:( )
(1)水溶液中A+B2+===A2++B;
(2)2C+2H2O(冷水)===2COH+H2↑;
(3)D、E为电极,与E盐溶液组成原电池,D电极反应为D-2e-===D2+;
(4)B可以溶于稀硫酸中,D不被稀硫酸氧化。
则这五种金属的活动性由弱到强的顺序是( )
A. D<E<B<A<C B. E<D<A<B<C C. E<D<B<A<C D. A<C<E<D<B
难度: 中等查看答案及解析
-
“绿水青山就是金山银山”,当前氮的氧化物的污染日趋严重,某企业处理该污染物的原理设计为燃料电池如图所示。在处理过程中石墨Ⅰ电极上生成氧化物Y,Y 可循环使用。下列说法不正确的是( )
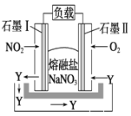
A. 该电池放电时电子流动的方向是:石墨Ⅰ电极→负载→石墨Ⅱ电极→熔融NaNO3→石墨Ⅰ电极
B. 石墨Ⅱ附近发生的反应:O2+4e-+2N2O5= 4NO3-
C. O2在石墨Ⅱ附近发生还原反应,Y 为N2O5
D. 相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1
难度: 中等查看答案及解析
-
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是( )
A. X2与Y2、Z2反应时,Y2更剧烈
B. Y与X形成化合物的沸点高于Y的同族元素与X形成化合物的沸点
C. CaX2与水发生氧化还原反应时,CaX2既是氧化剂又是还原剂
D. CaX2、CaY2和CaZ2等3种化合物中,阳离子与阴离子个数比均为1:2
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2===2AgCl。下列说法正确的是( )
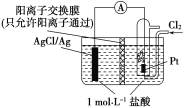
A. 负极反应为Ag-e-===Ag+
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 中等查看答案及解析
-
周期表前20号元素中有A、B、C、D、E五种主族元素。它们的原子半径依次减小,其中A和E同族元素,A、B原子最外层电子数之比为1∶4。A与C的电子层数相差2,且能形成原子个数比为1:1的化合物;B与E原子的电子层数也相差2。则下列推断正确的是( )
A. C为第二周期第ⅦA族元素
B. E与其他四种元素均形成共价化合物
C. B元素的单质可用作太阳能电池板
D. D的单质可以和E、C形成的化合物反应生成E单质
难度: 中等查看答案及解析
-
将V1 mL 2.0 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列说法正确的是( )

图1 图2
A. 据图1可知实验时的环境温度等于22 ℃。
B. 据图1可知该NaOH溶液的物质的量浓度为3.0mol∙L-1
C. 图2,如果在装有水的小试管中分别加入烧碱固体、浓硫酸、硝酸铵固体都能使a端液面高于b端液面
D. 若溶液比热容近似为4.18 J/(g∙℃),溶液密度近似为1g/mL。则该反应的中和热的数值为125.4 kJ/mol
难度: 中等查看答案及解析
-
某充电宝锂离子电池的总反应为:xLi+Li1-xMn2O4
LiMn2O4,某手机镍氢电池总反应为:NiOOH+MH
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
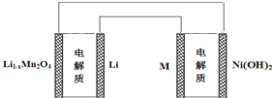
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极的电极反应式:NiOOH+H2O+e-=Ni(OH)2+OH-
C. 下图表示用锂离子电池给镍氢电池充电
D. 锂离子电池放电时,负极的电极反应式:Li1-xMn2O4+xLi+-xe-=LiMn2O4
难度: 中等查看答案及解析