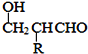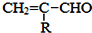-
下列对化学科学的认知错误的是
A.化学是一门以实验为基础的自然科学
B.化学家可以制造出自然界中不存在的物质
C.物质发生化学反应都伴随着能量变化
D.化学研究会造成严重的环境污染,人类终将毁灭在化学物质中
难度: 简单查看答案及解析
-
垃圾分类有利于资源回收利用下列垃圾归类不合理的是( )
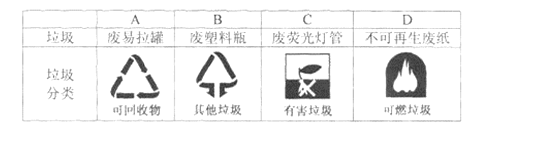
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.N2的电子式:
B.S2-的结构示意图:
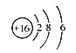
C.质子数为53,中子数为78的碘原子:
I
D.邻羟基苯甲酸的结构简式:
难度: 简单查看答案及解析
-
下列关于石油的说法正确的是
A.石油属于可再生矿物能源 B.石油主要含有碳、氢两种元素
C.石油裂化属于物理变化 D.石油分馏属于化学变化
难度: 中等查看答案及解析
-
如图是一种有机物的模型,该模型代表的有机物可能是( )
A.饱和一元醇 B.羟基酸
C.羧酸酯 D.饱和一元醛
难度: 简单查看答案及解析
-
有关NaCl晶体的性质,正确的是( )
A.易导热 B.易熔化 C.熔融状态能导电 D.有延展性
难度: 简单查看答案及解析
-
水的离子积常数随温度升高而升高。关于一定量的水,下列叙述正确的是
A.温度升高,水中分子总数减少 B.水中c(OH-)随温度升高而降低
C.水的pH随温度升高而升高 D.水的电离过程是放热过程
难度: 简单查看答案及解析
-
CH3COOH溶液与NaHCO3溶液反应的离子方程式正确的是
A.H + HCO3 → H2O + CO2↑
B.2CH3COOH + CO32 → H2O + CO2↑ + 2CH3COO
C.CH3COOH + HCO3 → H2O + CO2↑ + CH3COO
D.2H + CO32 → H2O + CO2↑
难度: 简单查看答案及解析
-
在稳定人体血液的pH中起作用的离子是
A.Na+ B.HCO3- C.Fe2+ D.Cl-
难度: 简单查看答案及解析
-
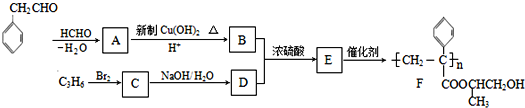
2-氯丁烷常用于有机合成等,有关2-氯丁烷的叙述正确的是( )
A.它的同分异构体除本身外还有4种
B.与硝酸银溶液混合产生不溶于稀硝酸的白色沉淀
C.微溶于水,可混溶于乙醇、乙醚、氯仿等多数有机溶剂
D.与氢氧化钠、乙醇在加热条件下的消去反应有机产物只有一种
难度: 中等查看答案及解析
-
一定温度下,恒容密闭容器中发生N2(g)+3H2(g)
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
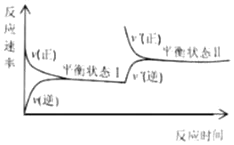
A.平衡状态Ⅱ时的c(H2)一定小 B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大 D.平衡状态Ⅱ时的v(正)一定大
难度: 中等查看答案及解析
-
关于氯化铵溶液,下列有关说法正确的是( )
A.溶液中c(NH4+)=c(Cl-)
B.加水稀释后溶液酸性增强
C.可除去某些金属表面的氧化物
D.微热促进水解平衡右移氯离子数目增多
难度: 中等查看答案及解析
-
元素的原子结构决定其性质和周期表中的位置。下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的区域内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强
D.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
为探究雾霾颗粒中的可溶性成分,某课外活动小组采集雾霾颗粒样品,用蒸馏水浸取得到浸取液,取浸取液进行以下实验,其中根据实验现象得出的结论正确的是
A.滴入NaOH溶液,有白色沉淀产生,说明雾霾中一定含Mg2+
B.滴入AgNO3溶液,有白色沉淀产生,说明雾霾中一定含Cl―
C.滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中一定含SO42―
D.加入浓NaOH溶液微热,试管口的湿润红色石蕊试纸变蓝,说明雾霾中一定含NH4+
难度: 中等查看答案及解析
-
已知还原性I->Fe2+ >Br-,在只含有I-、Fe2+、Br-的溶液中通入一定量的氯气,所得溶液中可能存在的离子是( )
A.I-、Fe3+ B.Fe2+、Br- C.Fe2+、Fe3+ D.Fe2+、I-
难度: 困难查看答案及解析
-
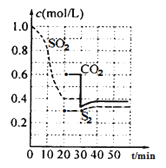
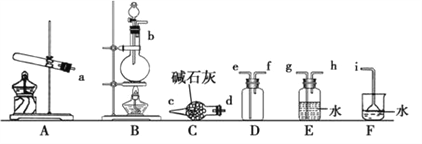
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.
 制取SO2 B.
制取SO2 B. 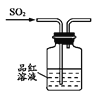 验证漂白性
验证漂白性C.
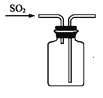 收集SO2 D.
收集SO2 D. 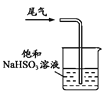 尾气处理
尾气处理难度: 中等查看答案及解析
-
常温下a mol/L稀氨水和b mol/L稀盐酸等体积混合,对混合后溶液判断一定正确的是( )
A.若a<b,则c(OH-)<c(H+) B.若a=b,则c(NH4+)=c(Cl―)
C.若a>b,则c(NH4+)>c(Cl―) D.若a>b,则c(OH-)>c(H+)
难度: 简单查看答案及解析
-
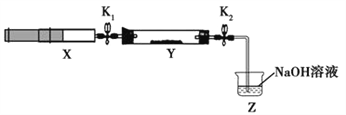
下列试验中,所选装置不合理的是
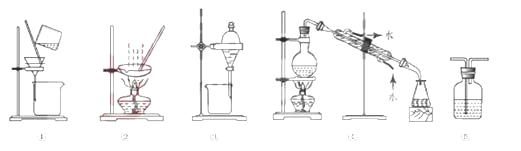
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CC14提取碘水中的碘,选③
C.用FeC12,溶液吸收C12,选⑤
D.粗盐提纯,选①和②
难度: 中等查看答案及解析
-
H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
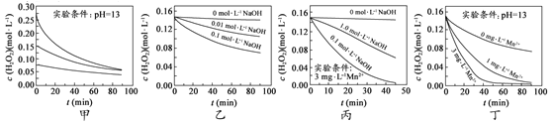
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
难度: 中等查看答案及解析