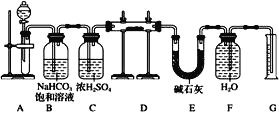
-
下列物质中,常用于治疗胃酸过多的是( )
A.碳酸钠 B.氢氧化铝 C.氧化钙 D.硫酸镁
难度: 简单查看答案及解析
-
数学中的有些逻辑关系(如下图)对帮助我们理解化学概念很有益处,下列说法正确的是( )
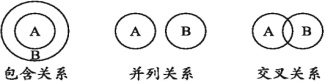
A.强电解质与弱电解质属于交叉关系
B.离子反应与复分解反应属于并列关系
C.胶体与分散系属于包含关系
D.化合物与电解质属于并列关系
难度: 简单查看答案及解析
-
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因有( )
A.NaOH固体放在滤纸上称量
B.NaOH固体中混有Na2O杂质
C.摇匀后发现液面低于刻度线,加水至刻度线
D.有少量NaOH溶液残留在烧杯中
难度: 简单查看答案及解析
-
下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,其阳离子只有氧化性
B.在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强
C.镁、铝在空气中都能形成致密氧化膜
D.金属元素的单质在常温下都为固体
难度: 简单查看答案及解析
-
下列实验设计方案不可行的是( )
A.某溶液中加入盐酸后有无色气体产生,该气体能够使澄清的石灰水变浑浊,则原溶液中含CO32-
B.用焰色反应鉴别NaCl和KNO3
C.先后添加石蕊试液、BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开
D.向试管中加水就可以鉴别萃取实验后分液漏斗中哪层是水层,哪层是有机层
难度: 简单查看答案及解析
-
某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42-、Cl-、NO3-、HCO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A.Ag+、K+、NO3-、HCO3- B.K+、NH4+、NO3-、SO42-
C.Ag+、NH4+、Mg2+、HCO3- D.K+、Mg2+、SO2、Cl-
难度: 简单查看答案及解析
-
对于等物质的量浓度的Na2CO3和NaHCO3溶液,下列说法错误的是( )
A.相同温度下两种溶液的pH:Na2CO3>NaHCO3
B.若分别加入少量澄清石灰水,两溶液中均会产生沉淀
C.生活中,人们常用纯碱作为食用碱而小苏打不能
D.纯碱溶液与盐酸可采用互滴法将其鉴别
难度: 简单查看答案及解析
-
某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2
2MgO+C,下列关于该反应的判断正确的是
A. Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B. 由此反应可以判断氧化性CO2>MgO,还原性Mg>C
C. CO2作氧化剂,表现氧化性,发生氧化反应
D. Mg原子失去的电子数目等于O原子得到的电子数目
难度: 中等查看答案及解析
-
下列实验现象描述不正确的是( )
选项
实 验
现 象
A
加热放在石棉网上的小块钠
钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体
B
在酒精灯上加热铝箔
铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着
C
点燃的镁条伸入盛有O2的集气瓶
底部铺有少量细砂)中
镁条继续燃烧,发出耀眼白光放出大量热量,生成白色固体
D
系有火柴的细铁丝引燃后伸入盛有O2的集气瓶(底部铺有少量细砂)中
铁丝剧烈燃烧,火星四射,生成红色固体
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列变化通过一步实验不能直接完成的是( )
A.Fe→Fe3O4 B.Al2O3→Al(OH)3 C.Na2CO3→NaOH D.Na2O→Na2O2
难度: 简单查看答案及解析
-
下列各组在溶液中的反应,不管反应物量的多少,都只能用同一个离子方程式来表示的是( )
A.FeBr2与Cl2 B.Ba(OH)2与NaHSO4
C.CO2与NaOH D.Ca(HCO3)2与Ca(OH)2
难度: 简单查看答案及解析
-
某溶液中含有下列六种离子:①HCO3-②SO32-③Na+④CO32- ⑤NH4+⑥NO3-,向其中加入一定量Na2O2后,溶液中离子浓度基本保持不变的是
A.只有⑥ B.④⑥ C.③④⑥ D.①②⑤
难度: 中等查看答案及解析
-
已知:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是( )
A.①②均是氧化还原反
B.氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C.反应②中氧化剂与还原剂的物质的量之比为6:1
D.反应③中0.1mol还原剂共失去电子数为6.02×1023
难度: 简单查看答案及解析
-
将m克Fe2O3、Al2O3样品溶解在过量的200mL0.1mol·L-1的硫酸溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100mL,则NaOH溶液的浓度为( )
A.0.1mol·L-1 B.0.2mol·L-1 C.0.4mol·L-1 D.0.8mol·L-1
难度: 简单查看答案及解析
-
将0.4gNaOH和1.069
混合并配成溶液,向溶液中滴加0.1mol·
稀盐酸。下列图像能正确表示加入盐酸的体积和生成
的物质的量的关系的是
A.
 B.
B.
C.
 D.
D.
难度: 中等查看答案及解析
-
已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O,IO3﹣→I2,MnO4-→Mn2+,HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是
A. H2O2 B. IO3-
C. MnO4- D. HNO2
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-
Cl2↑+Mn2++H2O
B.稀硫酸与NaOH溶液反应:2H++2OH-=2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH) 2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
Fe(OH) 3(胶体)+3H+
难度: 简单查看答案及解析
-
将一块金属钠分别投入到下列物质的溶液中,有气体放出且溶液质量减轻的是( )
A.K2SO4 B.HCl C.BaCl2 D.FeCl3
难度: 简单查看答案及解析
-
工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述不正确的是( )
A.试剂X可以是氢氧化钠溶液
B.反应①过滤后所得沉淀为氧化铁
C.图中所示转化反应都不是氧化还原反应
D.反应①的离子方程式为Al2O3+2OH-=2AlO2-+H2O
难度: 中等查看答案及解析
-
在一定条件下,使H2和O2的混合气体26g充分发生反应,所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。原混合气体中H2和O2的物质的量之比为( )
A.1:10 B.9:1 C.4:1 D.4:3
难度: 中等查看答案及解析