-
下列表示不正确的是
A.氯原子的结构示意图
B.二氧化碳的结构式:O=C=O
C.CH4的球棍模型
D.乙醛的官能团 -CHO
难度: 简单查看答案及解析
-
下列各离子方程式中,属于水解反应的是
A.HCO3-+H2O
H3O++CO32-
B.NH4++H2O
NH3·H2O+OH-
C.PO43-+H2O
HPO42-+OH-
D.H2O+H2O
H3O++OH-
难度: 中等查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是
A.pH = 2 的CH3COOH溶液 B.0.01 mol/L Na2CO3溶液
C.0. 1 mol/L盐酸 D.pH =10氨水
难度: 简单查看答案及解析
-
用已知浓度的盐酸滴定未知浓度的NaOH溶液时,下列操作中不正确的是
A.酸式滴定管用蒸馏水洗净后,必须用已知浓度的盐酸润洗
B.锥形瓶用蒸馏水洗净后,用NaOH溶液润洗后再加入待测液
C.滴定时,必须逐出滴定管下口的气泡
D.读数时,视线与滴定管内液体的凹液面最低处保持水平
难度: 中等查看答案及解析
-
下列有机物的命名正确的是 ( )
A.3,3-二甲基丁烷 B.2,2-二甲基丁烷
C.2-乙基丁烷 D.2,3,3-三甲基丁烷
难度: 简单查看答案及解析
-
某烷烃分子量为72,跟氯气反应生成的一氯代物只有一种,它是:
A.戊烷 B.2—甲基丁烷
C.己烷 D.2,2—二甲基丙烷
难度: 简单查看答案及解析
-
相同温度下,关于盐酸和醋酸两种溶液的比较,下列说法正确的是
A.pH相等的两溶液:c(CH3COO-)=c(Cl-)
B.等浓度的盐酸和醋酸中和相同物质的量的NaOH时,盐酸的体积小
C.同pH值时,稀释相同倍数后,醋酸溶液的pH值大
D.等pH值的盐酸和醋酸与铁粉反应,产生气体的速率盐酸快
难度: 中等查看答案及解析
-
根据下列实验不能证明一元酸HR为弱酸的是( )
A.室温下,NaR溶液的pH大于7
B.HR溶液加入少量NaR固体,溶解后溶液的pH变大
C.加热NaR溶液时,溶液的pH变小
D.70 ℃时,0.01 mol·L-1的HR溶液pH=2.8
难度: 中等查看答案及解析
-
下列化合物中的所有原子可能都在同一平面上的是
A.CH3(CH2)4CH3 B.CH3CH2CHO
C.CH2=CHCH=CH2 D.(CH3)3C-C≡C-CH=CHCH3
难度: 中等查看答案及解析
-
已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol•L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应为
A. 2.8×10-2 mol•L-1 B. 1.4×10-5 mol•L-1
C. 2.8×10-5 mol•L-1 D. 5.6×10-5 mol•L-1
难度: 中等查看答案及解析
-
在由水电离的c(H+)=10-14mol·L-1的溶液中,一定能大量共存的离子组是
A.K+、Fe2+、S2-、MnO4- B.Al3+、Cl-、NH4+、SO42-
C.Na+、NO3-、Cl-、SO42- D.Na+、AlO2-、Br-、Cl-
难度: 中等查看答案及解析
-
下列实验操作和数据记录都正确的是( )
A.用托盘天平称量时,将NaOH固体放在右盘内的纸上,称得质量为10.2 g
B.用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL
C.用干燥的广泛pH试纸测稀盐酸的pH=3.2
D.用10 mL量筒量取NaCl溶液,体积为9.2 mL
难度: 中等查看答案及解析
-
将相同物质的量浓度的某弱酸HX溶液与NaX溶液等体积混合,测得混合后溶液中c(Na+)<c(X-),则下列关系错误的是
A.c(HX)>c(X-)
B.c(HX)+c(H+)=c(Na+)+c(OH-)
C.c(X-)+c(HX)=2c(Na+)
D.c(OH-)<c(H+)
难度: 中等查看答案及解析
-
常温下,0.1mol/L某一元酸(HA)溶液中
=1×10-8,下列叙述正确的是( )
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的=c(H+)=1×10-11mol/L
C.该溶液中水的离子积常数为1×10-22
D.用pH=11的氢氧化钠溶液V1L与V2L0.1mol/L该一元酸(HA)溶液混合,若混合溶液的pH=7,则V1<V2
难度: 中等查看答案及解析
-
时,水的离子积为
,该温度下将
,一元酸
与
一元碱
等体积混合,要使混合液呈中性,必要的条件是
A.混合液的
B.混合液中,
C.
D.混合液中,
难度: 简单查看答案及解析
-
某烯烃与氢气加成后得到2,2-二甲基丁烷,则该烯烃的名称是( )
A. 3,3-二甲基-1-丁烯 B. 2,2-二甲基-2-丁烯
C. 2,2-二甲基-1-丁烯 D. 2,2-二甲基-3-丁烯
难度: 简单查看答案及解析
-
由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为
A.26.7% B.15.6% C.30% D.无法确定
难度: 中等查看答案及解析
-
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是
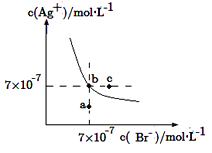
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 简单查看答案及解析
-
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
A.CaCO3的溶解度小于CaSO4
B.沉淀转化的实质是沉淀溶解平衡的移动
C.沉淀转化的难易与溶解度差别的大小无关
D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡
难度: 中等查看答案及解析
-
1体积某气态烃和2体积氯化氢发生加成反应后,最多还能和6体积氯气发生取代反应.由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.乙炔 B.丙炔 C.丁炔 D.1,3﹣丁二烯
难度: 中等查看答案及解析
-
将0.1mol/L CH3COOH溶液加入水稀释或加入少量CH3COONa晶体时,都会引起
A. 溶液中pH增大 B. CH3COOH的电离程度变大
C. 溶液的导电能力减弱 D. CH3COO-的浓度变小
难度: 中等查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
难度: 中等查看答案及解析
-
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1000mL,其pH与溶液体积的关系如图,下列说法正确的是( )
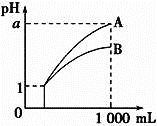
①若a<4,则A、B都是弱酸
②稀释后,A酸溶液的酸性比B酸溶液强
③若a=4,则A是强酸,B是弱酸
④A、B两种酸溶液的物质的量浓度一定相等
A. ①④ B. ②③ C. ②④ D. ①③
难度: 困难查看答案及解析
-
25℃时,Ksp(BaSO4)=1×10-10,Ksp (BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中,
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
难度: 中等查看答案及解析
-
电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。右图是某同学用0.1mol•L-1KOH溶液分别滴定体积均为20mL、浓度均为0.1mol•L-1的HCl和CH3COOH溶液滴定曲线示意图(混合溶液体积变化忽略不计).下列有关判断不正确的是
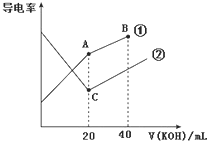
A.曲线①代表0.1 mol•L-1KOH溶液滴定CH3COOH溶液的滴定曲线
B.在A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.05 mol•L-1
C.在B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
D.在相同温度下,C点水电离的c(H+)大于A点水电离的c(H+)
难度: 困难查看答案及解析
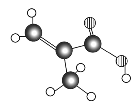
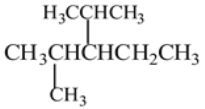 的烃可命名为:________________________________。
的烃可命名为:________________________________。 此烃名称为____________________________。
此烃名称为____________________________。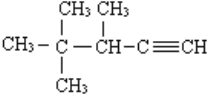 的系统名称为________________
的系统名称为________________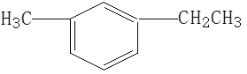 的烃可命名为___________________。
的烃可命名为___________________。