-
下列措施不符合节能减排的是( )
A. 在屋顶安装太阳能热水器为居民提供生活用热水
B. 大力发展火力发电,解决电力紧张问题
C. 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
难度: 简单查看答案及解析
-
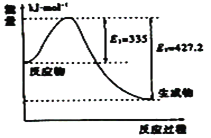
某化学反应的能量变化如图所示,下列有关叙述正确的是

A.该反应为放热反应
B.加入催化剂,可同时降低E1、E2
C.该反应的反应热ΔH=(E1-E2)kJ·mol-1
D.E2可表示形成新的化学键所释放的能量
难度: 中等查看答案及解析
-
下列过程中△H<0的是( )
A.氯酸钾分解制氧气。 B.氯化铵加热制备氨气。
C.碳与二氧化碳高温生成一氧化碳。 D.实验室制备氢气。
难度: 简单查看答案及解析
-
下列有关热化学方程式的叙述,正确的是
A.若2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1,则1mol碳完全燃烧放出的热量大于110.5kJ
B.若CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-812.3kJ/mol,则甲烷的燃烧热为812.3kJ/mol
C.若2NO2(g)
N2O4(g) ΔH=56.9kJ·mol-1,则2molNO2(g)置于密闭容器中充分反应吸收热量为56.9kJ
D.若H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1,含1 mol CH3COOH的溶液与含1molNaOH的溶液混合,放出热量为57.3kJ
难度: 中等查看答案及解析
-
下列事实不能说明亚硝酸是弱电解质的是( )
①亚硝酸是共价化合物 ②用HNO2溶液做导电实验,灯泡很暗
③石蕊滴入亚硝酸可使溶液变红 ④0.1mol·L-1HNO2溶液的pH=2.1
A.①②③ B.②③④ C.①③④ D.①②④
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.钢铁在潮湿空气中生锈属于电化学腐蚀
B.电解水生成H2和O2的实验中,可加入少量盐酸或硫酸增强导电性
C.同一可逆反应使用不同的催化剂时,高效催化剂可增大平衡转化率
D.升高温度能使吸热反应速率加快,使放热反应速率减慢
难度: 简单查看答案及解析
-
《本草纲目》中载有一药物,名“铜青”。藏器曰:生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。时珍曰:近时人以醋制铜生绿,取收晒干货之。后者的反应原理为
A.析氢腐蚀 B.吸氧腐蚀 C.化学腐蚀 D.置换反应
难度: 中等查看答案及解析
-
反应3H2+N2
 2NH3在容积固定的密闭容器中进行。下列做法无法加快反应速率的是
2NH3在容积固定的密闭容器中进行。下列做法无法加快反应速率的是A.升高温度
B.使用高效的催化剂
C.增大N2的浓度
D.充入稀有气体增大装置内的压强
难度: 简单查看答案及解析
-
炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
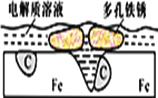
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
难度: 中等查看答案及解析
-
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是
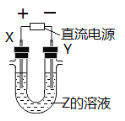
A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠
B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4
C.海水提镁中,X、Y均为石墨,Z为MgCl2溶液
D.电镀工业中,X是镀层金属,Y是待镀金属
难度: 中等查看答案及解析
-
锂—铜空气燃料电池是低成本高效电池。该电池通过一种复杂的铜“腐蚀”现象产生电能,其中放电过程为2Li+Cu2O+H2O===2Cu+2Li++2OH-。下列说法不正确的是
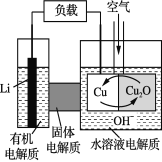
A. 放电时,Li+透过固体电解质向Cu极移动
B. 通空气时,铜被腐蚀,产生Cu2O
C. 放电时,正极的电极反应式为:Cu2O+2H+ +2 e- ===2Cu+H2O
D. 整个反应过程中,氧化剂为O2
难度: 中等查看答案及解析
-
通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键
Si—O
Si—Cl
H—H
H—Cl
Si—Si
Si—C
键能/kJ·mol-1
460
360
436
431
176
347
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
Si(s)+4HCl(g),该反应的反应热△H为
A. +236 kJ·mol-1 B. -236 kJ·mol-1
C. +412 kJ·mol-1 D. -412 kJ·mol-1
难度: 简单查看答案及解析
-
一定温度下,在某密闭容器中发生反应:2HI(g)
H2(g)+I2(s),若0~15 s内c(HI)由0.1 mol·L-1减小到0.07 mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.001 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
难度: 中等查看答案及解析
-
把足量铝条放入盛有一定体积的稀盐酸的试管中,使反应速率降低且不影响氢气产生量的因素是
A.降低盐酸的浓度 B.加入少量CuSO4固体
C.加入少量的K2CO3溶液 D.加少量Na2SO4溶液
难度: 中等查看答案及解析
-
一定温度下,在体积为1L的密闭容器内进行着某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图。下列叙述中正确的是
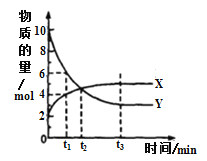
A.反应的化学方程式为
B.
时,Y的浓度是X浓度的
倍
C.根据
时的数据,可求出该温度下的平衡常数
D.
时,逆反应速率大于正反应速率
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中发生反应:2SO2(g)+O2(g)
2SO3(g),下列证据能说明反应一定达到化学平衡状态的是
A.容器内的压强不再改变 B.c(SO2):c(O2):c(SO3)=2:1:2
C.混合气体的密度不再改变 D.SO2的生成速率与SO3的消耗速率相等
难度: 中等查看答案及解析
-
对于可逆反应N2(g)+3H2(g)
2NH3(g) △H<0,下列研究目的和示意图相符的是( )
A
B
C
D
研究目的
压强对反应的影响
(p2>p1)
温度对反应的影响
平衡体系中增加N2的浓度对反应的影响
催化剂对反应的影响
示意图

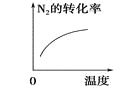
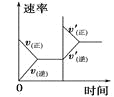
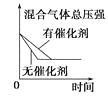
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
用水稀释0.1mol/L的氨水,溶液中随着水量的增加而减小的是
A.c(H+)/c(NH4+) B.c(NH3·H2O)/ c(OH-)
C.c(NH4+) c(OH-)/c(NH3·H2O) D.c(H+)c(OH-)
难度: 简单查看答案及解析
-
已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10mL浓度为0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
A.水的电离程度始终增大
B.
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO-)
难度: 中等查看答案及解析
-
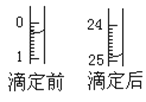
25℃时,用0.100 mol·L-1的NaOH溶液滴定20.00 mL 0.100 mol·L-1的HNO2溶液,
与所加NaOH溶液体积的关系如图所示,下列说法错误的是( )
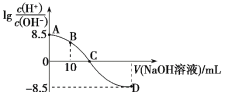
A.25 ℃时,0.100 mol·L-1的HNO2溶液的pH=2.75
B.B点对应的溶液中,2c(H+)+c(HNO2)=c(NO2-)+2c(OH-)
C.C点对应的溶液的pH=7,加入NaOH溶液的体积为20.00 mL
D.滴定过程中从A到D点溶液中水的电离程度先增大后减小
难度: 中等查看答案及解析