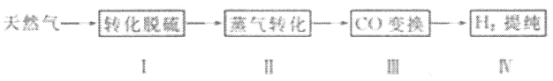
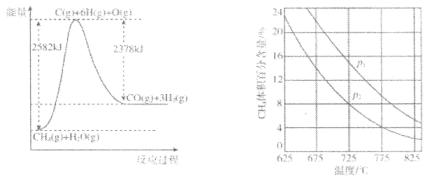
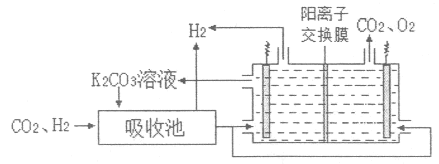
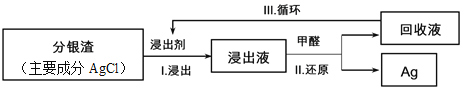
-
下列关于元素周期表应用的说法正确的是
A. 为元素性质的系统研究提供指导,为新元素的发现提供线索
B. 在金属与非金属的交界处,寻找可做催化剂的合金材料
C. 在IA、IIA族元素中,寻找制造农药的主要元素
D. 在过渡元素中,可以找到半导体材料
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol OH- 含有的电子数目为10NA
B. 1mol Cl2溶于水,转移电子的数目为NA
C. 标准状况下,2.24 L CCl4含有的分子数目为0.1NA
D. 1L 1 mol·L-1 Na2CO3溶液中含有的CO32-数目为NA
难度: 中等查看答案及解析
-
下列现象或活动过程中不发生氧化还原反应的是




A 雷电
B用我国研发的天眼接受宇宙中的信号
C航空煤油用作水路两用飞机的飞行燃料
D 手机充电
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
三氟化氮(NF3)常用于微电子工业,可用以下反应制备:4NH3+3F2=NF3+3NH4F,下列说法中,正确的是( )
A.NF3的电子式为
B.NH4F分子中仅含离子键
C.在制备NF3的反应中,NH3表现出还原性
D.在制备NF3的反应方程式中,各物质均为共价化合物
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是
A.原子半径:r(X) < r(Y) < r(Z) < r(W)
B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强
D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
难度: 中等查看答案及解析
-
下列各组离子在强碱性环境下可以大量共存的是( )
A.MnO4-、I-、Al3+、NH4+ B.Ca2+、HCO3-、CH3COO-、ClO-
C.Na+、SO42-、NO3-、K+ D.Fe3+、Mg2+、SCN-、Cl-
难度: 中等查看答案及解析
-
下列解释事实的方程式书写正确的是( )
A.Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-=CaCO3↓
B.Na2O2作呼吸面具的供氧剂:2Na2O2+2CO2=2Na2CO3+O2
C.稀HNO3洗涤做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O
D.FeCl3溶液腐蚀线路板:Fe3++Cu=Fe2++Cu2+
难度: 中等查看答案及解析
-
在浓盐酸中H3AsO3可与SnCl2反应,反应的离子方程式为3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl6-+6M。下列关于该反应的说法中,错误的是( )
A.M为H2O
B.每还原1mol氧化剂,就有3mol电子转移
C.还原性:SnCl2>As
D.氧化产物和还原产物的物质的量之比为2:3
难度: 中等查看答案及解析
-
某科研团队研制出“TM﹣LiH(TM表示过渡金属)”双催化剂体系,显著提高了在温和条件下氮气和氢气合成NH3的效率,原理示意如下:
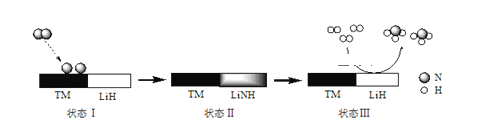
下列分析不合理的是( )
A.状态Ⅰ,吸收能量并有N≡N键发生断裂 B.合成NH3总反应的原子利用率是100%
C.“TM﹣LiH”能降低合成氨反应的△H D.生成NH3:2LiNH+3H2═2LiH+2NH3
难度: 中等查看答案及解析
-
某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号
实验操作
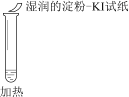
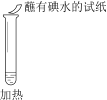
实验现象
溶液不变红,试纸不变蓝
溶液不变红,试纸褪色
生成白色沉淀
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42−
D. 实验条件下,品红溶液和SO2均被氧化
难度: 中等查看答案及解析
-
CO2催化加氢制取甲醇的研究,对于环境、能源问题都具有重要的意义。反应如下:
反应ⅰ:CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) ∆H1 =﹣58 kJ· mol-1
反应ⅱ:CO2(g) + H2(g) ⇌ CO(g) + H2O(g) ∆H2 = +42 kJ· mol-1
下列说法不正确的是
A.增大氢气浓度能提高二氧化碳的转化率
B.增大压强,有利于向生成甲醇的方向进行,反应ⅰ的平衡常数增大
C.升高温度,生成甲醇的速率加快,反应ⅱ的限度同时增加
D.选用理想的催化剂可以提高甲醇在最终产物中的比率
难度: 中等查看答案及解析
-
下列实验所得结论正确的是
①
②
③
④
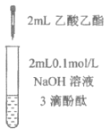

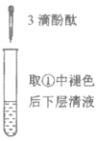
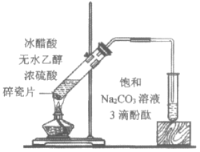
充分振荡试管,下层溶液红色褪去
溶液变红
溶液变红
充分振荡右侧小试管,
下层溶液红色褪去
A.①中溶液红色褪去的原因是:CH3COOC2H5+NaOH
CH3COONa+C2H5OH
B.②中溶液变红的原因是:CH3COO-+H2O
CH3COOH+H+
C.由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D.④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
难度: 中等查看答案及解析
-
HI常用作有机反应中的还原剂,受热会发生分解反应。已知443℃时:2HI(g)
H2(g)+I2(g) △H=+12.5kJ·mol-1向1L密闭容器中充入1mol HI,443℃时,体系中c(HI)与反应时间t的关系如图所示。下列说法中,正确的是( )

A.0~20min内的平均反应速率可表示为v(H2)=0.0045mol·L-1·min-1
B.升高温度,再次平衡时,c(HI)>0.78mol·L-1
C.该反应的化学平衡常数计算式为
D.反应进行40 min时,体系吸收的热量约为0.94kJ
难度: 困难查看答案及解析
-
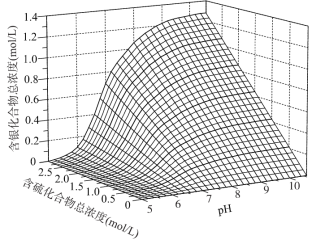
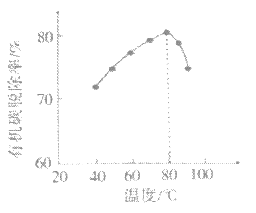
(NH4)2SO3氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间内温度和(NH4)2SO3初始浓度对空气氧化(NH4)2SO3速率的影响,结果如图。下列说法不正确的是
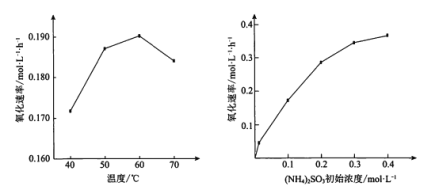
A.60℃之前,氧化速率增大与温度升高化学反应速率加快有关
B.60℃之后,氧化速率降低可能与O2的溶解度下降及(NH4)2SO3受热易分解有关
C.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与SO32-水解程度增大有关
D.(NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与O2的溶解速率有关
难度: 困难查看答案及解析