-
下列现象或应用不能用胶体的知识解释的是( )
A. 清晨,人们经常看到阳光穿过茂密的树木枝叶所产生的美丽景象
B. 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力
C. 向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
D. 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
难度: 中等查看答案及解析
-
化学实验时,必须十分重视安全和环保问题。下列操作方法不符合要求的是
A. 少量的浓硫酸溅到皮肤上时,应用大量的水冲洗并涂上3%~5%的NaHCO3溶液
B. 氢气还原氧化铜时为防止氢气损耗应该先加热后通氢气
C. 使用容量瓶、分液漏斗前,先检查是否漏水
D. 给试管中的液体加热时,沿试管倾斜方向不停移动试管或加入碎瓷片,以免液体暴沸伤人
难度: 简单查看答案及解析
-
下列实验操作错误的是( )
A. 分液时,先从下口放出下层液体,再从上口倒出上层液体
B. 向试管中滴加液体时,胶头滴管紧贴试管内壁
C. 向容量瓶中转移液体时,用玻璃棒引流
D. 过滤时,漏斗下端紧贴烧杯内壁
难度: 中等查看答案及解析
-
下列各种混合物中,能用分液漏斗进行分离的是( )
A.酒精和水 B.水和四氯化碳 C.碘和四氯化碳 D.汽油和植物油
难度: 简单查看答案及解析
-
在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A.该溶液溶质的物质的量浓度为1 mol·L-1
B.该溶液中含有58.5 g NaCl
C.配制100 mL该溶液需用5.85 g NaCl
D.量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
难度: 中等查看答案及解析
-
某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.一定有SO42- B.可能有SO42-或Ag+
C.一定无Ag+ D.还可能有CO32-
难度: 中等查看答案及解析
-
下列关于物质分类及胶体性质描述正确的是( )
A.明矾、空气、硫酸铜均为纯净物
B.熟石灰、烧碱、纯碱都是碱
C.纳米材料粒子直径一般从几纳米到几十纳米,因此纳米材料属于胶体
D.“血液透析”和“静电除尘”分别利用了胶体的不同性质
难度: 中等查看答案及解析
-
用
表示阿伏伽德罗常数的值,下列判断正确的是( )
A.在标准状况下,
L CO和
的混合物的物质的量为1mol
B.常温常压下,
含有的分子数目为
C.28g
含有的氮原子数目为
D.
溶液中含有的钾离子数目为
难度: 中等查看答案及解析
-
下列电离方程式错误的是( )
A.HNO3 = H+ + NO3- B.NaHCO3 = Na+ + HCO3-
C.BaCl2 = Ba2+ + Cl2- D.Na2SO4 = 2Na+ + SO42-
难度: 中等查看答案及解析
-
碳酸钠俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
A.碱 B.含氧酸盐 C.钠盐 D.碳酸盐
难度: 中等查看答案及解析
-
下列类型的反应一定属于氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.N2的摩尔质量为28g B.标准状况下NH3的体积为22.4L
C.17 g NH3的物质的量是1 mol D.22.4 L N2的物质的量为1 mol
难度: 中等查看答案及解析
-
下列反应的离子方程式,书写错误的是( )
A.氢氧化钠与盐酸反应 OH-+H+=H2O
B.用稀硫酸清除铁锈 Fe2O3+6H+=2Fe3++3H2O
C.食盐水中滴加硝酸银溶液 Cl-+Ag+=AgCl↓
D.氢氧化钡跟硫酸铜溶液反应 Ba2++SO42-=BaSO4↓
难度: 中等查看答案及解析
-
在下列反应中,CO2作氧化剂的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
下列实验所需选择的装置或仪器都正确的是( )。
选项
A
B
C
D
实验
分离植物油和氯化钠溶液
除去氯化钠晶体中混有的氯化铵晶体
分离CCl4中的Br2
除去CO2气体中的HCl气体
装置
或
仪器
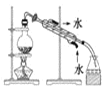
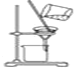

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
配制250 mL 0.2 mol·L-1的KNO3溶液,需量取4 mol·L-1 KNO3溶液的体积为 ( )
A.125 mL B.50 mL C.12.5 mL D.75 mL
难度: 中等查看答案及解析
-
下列各组离子中的离子,能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl-、OH- B.H+、Ca2+、CO32-、NO3-
C.Cu2+、K+、SO42-、NO3- D.Na+、H+、OH-、Ca2+
难度: 简单查看答案及解析
-
下列化学实验操作正确的是
A.点燃酒精灯
 B.称量10.05g固体
B.称量10.05g固体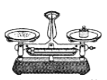
C.加热液体
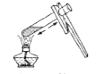 D.量取9.5mL的液体
D.量取9.5mL的液体
难度: 中等查看答案及解析
-
448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( )
A.32g B.64 C.64g·mol-1 D.32 g·mol-1
难度: 简单查看答案及解析
-
下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A.Fe+CuSO4===FeSO4+Cu B.Fe2O3+3CO
2Fe+3CO2
C.AgNO3+NaCl===AgCl↓+NaNO3 D.MgCl2(熔融)
Mg+Cl2↑
难度: 中等查看答案及解析
-
关于氧化还原反应,下列说法正确的是( )
A.失去电子,化合价降低的物质是还原剂 B.被氧化的物质是还原剂
C.氧化剂被氧化,还原剂被还原 D.氧化剂失去电子,化合价升高
难度: 中等查看答案及解析
-
下列物质中属于非电解质的是
A.H2SO4 B.NaOH C.Na2CO3 D.蔗糖
难度: 中等查看答案及解析
-
鉴别硫酸钠溶液与氢氧化铁胶体最简便的方法是( )
A.萃取 B.蒸馏 C.过滤 D.丁达尔效应
难度: 简单查看答案及解析
-
0.5 mol Na2CO3中所含的Na+数约为( )
A.3.01×1023 B.6.02×1023 C.0.5 D.1
难度: 简单查看答案及解析
-
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴上危险警告标签。下面所列物质贴错了标签的是( )
A
B
C
D
物质
氢氧化钠
金属汞
四氯化碳
烟花爆竹
危险警
告标签

A.A B.B C.C D.D
难度: 简单查看答案及解析
-
根据下列反应:(1)2Fe3++2I-=2Fe2++I2;(2)Br2+2Fe2+=2Br-+2Fe3+,判断离子的还原性由强到弱的顺序是( )
A.Br->I->Fe2+ B.I->Fe2+>Br-
C.Fe2+>I->Br- D.Br->Fe2+>I-
难度: 简单查看答案及解析
-
下列反应能用离子方程式H++OH-=H2O表示的是( )
A.澄清石灰水和稀硝酸反应 B.H2SO4溶液与Ba(OH)2溶液反应
C.氢氧化镁和稀盐酸反应 D.CH3COOH溶液与NaOH溶液反应
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O32-+O2+XOH- =Fe3O4+S4O62-+2H2O,下列说法正确的是( )
A. 硫元素被氧化,铁元素被还原
B. Fe2+、S2O32- 都是还原剂
C. X=2
D. 每生成1mol Fe3O4,则转移电子数2mol
难度: 中等查看答案及解析
-
某试剂瓶上贴有如下标签“100mL 1.0mol•L﹣1MgCl2 溶液”,对该试剂理解正确的是( )
A.该溶液中含有的微粒主要有:MgCl2、Mg2+、Cl﹣、H2O
B.若取 50mL 溶液,其中的 c(Cl﹣)=1 mol•L﹣1
C.取该溶液 5.0 mL 恰好与 0.1 mol•L﹣1 AgNO3100 mL 溶液完全反应
D.该溶液与 100mL 1.0 mol•L﹣1 NaCl 溶液中的 c(Cl﹣)相等
难度: 中等查看答案及解析
-
硫酸钾、硫酸铝和硫酸组成的混合溶液c(H+)=0.1 mol·L-1,c(Al3+)=0.4 mol·L-1,c(SO42-)=0.8 mol·L-1,则c(K+)为( )
A.0.15 mol·L-1 B.0.2 mol·L-1 C.0.3 mol·L-1 D.0.4 mol·L-1
难度: 简单查看答案及解析
