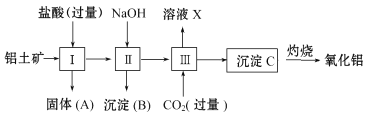
-
中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的 ( )
A. 蒸馏 B. 过滤 C. 蒸发 D. 搅拌
难度: 简单查看答案及解析
-
某工厂排放的工业废水中可能含有K+、H+、Mg2+、SO42-、Cl-、NO3-等离子。经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
A. H+、K+、NO3- B. K+、NO3-、SO42- C. H+、Mg2+ D. K+、Mg2+、SO42-、Cl-
难度: 简单查看答案及解析
-
下列转化过程中必须加入还原剂的是
A. FeS→H2S B. SO2→SO32- C. Fe3+→Fe2+ D. Cu→Cu2+
难度: 简单查看答案及解析
-
药物“胃舒平”中含有氢氧化铝,可用来治疗胃酸(主要成分是盐酸)过多。该反应属于
A. 化合反应 B. 分解反应 C. 置换反应 D. 复分解反应
难度: 简单查看答案及解析
-
华裔科学家高锟因“在光学通信领域中光在光导纤维中传输”的研究方面所取得的开创性成就获得了诺贝尔物理学奖。光导纤维的主要成分是( )
A. Si B. SiO2 C. Na2SiO3 D. SiCl4
难度: 简单查看答案及解析
-
把7.4 g由 Na2CO3•10H2O 和 NaHCO3组成的混合物溶于水配成100mL溶液, 其中c(Na+)=0.6 mol•L-1。若把等质量的混合物加热至恒重,残留物的质量是
A. 2.12g B. 3.18g C. 4.22g D. 5.28g
难度: 简单查看答案及解析
-
苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变化为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生。这说明维生素C具有( )
A.氧化性 B.还原性 C.碱性 D.酸性
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子
B.1mol Na2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.23gNa+中含有的电子数为NA
难度: 中等查看答案及解析
-
溶液、胶体和浊液这三种分散系的本质区别是( )
A. 是否有丁达尔现象 B. 是否能通过滤纸
C. 分散质粒子的大小 D. 是否均一、透明、稳定
难度: 简单查看答案及解析
-
将4克NaOH溶解在10ml水中,在稀释成1L溶液,从中取出10ml,这10ml溶液的物质的量浓度为( )
A.0.01mol/L B.0.1mol/L C.1mol/L D.10mol/L
难度: 简单查看答案及解析
-
海水中含有MgCl2,从海水中提取镁,正确的方法是
A.海水
Mg(OH)2
Mg
B.海水
MgCl2溶液→ MgCl2(熔融)
Mg
C.海水
Mg(OH)2
MgO
Mg
D.海水
Mg(OH)2
MgCl2溶液 → MgCl2(熔融)
Mg
难度: 中等查看答案及解析
-
将少量氯水加入KI溶液中振荡,再加入CCl4,振荡,静置后观察到的现象是
A. 形成均匀的紫色溶液 B. 有紫色沉淀析出
C. 液体分层,上层呈紫红色 D. 液体分层,下层呈紫红色
难度: 中等查看答案及解析
-
下列物质的鉴别方法不正确的是
A.用氢氧化钠溶液鉴别MgCl2和AlCl3溶液
B.利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液
C.用焰色反应鉴别NaCl、KCl和Na2SO4
D.用氯化钙溶液鉴别Na2CO3和NaHCO3两种溶液
难度: 中等查看答案及解析
-
下列物质间的每步转化只需通过一步反应就能实现的是( )
A.Fe→Fe2O3→Fe(OH)3→FeCl3 B.Al→Al(OH)3→Al2O3→NaAlO2
C.Na→Na2O2→Na2CO3→NaOH D.Si→SiO2→H2SiO3→Na2SiO3
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用,下表中用途与其性质或原理对应关系不正确的是 ( )
选项
现象或事实
解释
A
Na2O2常用于潜水艇或呼吸面具的供氧剂
Na2O2与H2O、CO2反应产生O2
B
常用铝箔做包装材料
金属铝有好的延展性
C
FeCl3溶液可用于刻制印刷铜电路板
FeCl3可与Cu发生反应
D
烧菜用过的铁锅,经放置常出现红棕色斑迹
烧菜时铁锅被染色
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
向盛有氯化铁溶液的烧杯中加入过量的铜粉,反应结束后,溶液中大量存在的金属离子是
A.Fe2+、Fe3+ B.Fe2+、Cu2+
C.Fe3+、Cu2+ D.Cu+、Cu2+
难度: 中等查看答案及解析
-
下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②液氯 ③新制氯水 ④氯气的四氯化碳溶液⑤盐酸 ⑥盐酸与少量漂白粉的混合溶液
A. ①②④ B. ①②⑤
C. ③⑥ D. ②④⑤
难度: 中等查看答案及解析