-
下列叙述正确的是 ( )
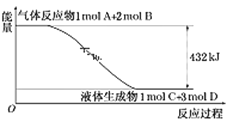
A.物质燃烧不一定是放热反应
B.放热反应不需要从外界吸收任何能量就能发生
C.在一个确定的化学反应中,反应物总能量总是高于生成物总能量
D.化学反应除了生成新的物质外,还伴随着能量的变化
难度: 简单查看答案及解析
-
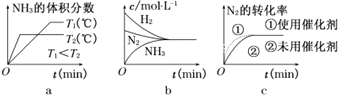
已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
难度: 简单查看答案及解析
-
根据盖斯定律判断如下图所示的物质转变过程中,正确的等式是( )
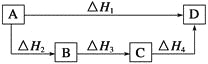
A.ΔH1=ΔH2=ΔH3=ΔH4 B.ΔH1+ΔH2=ΔH3+ΔH4
C.ΔH1+ΔH2+ΔH3=ΔH4 D.ΔH1=ΔH2+ΔH3+ΔH4
难度: 简单查看答案及解析
-
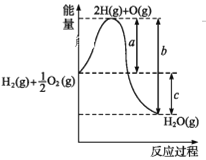
已知在298 K条件下,2mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )。
A.2H2(g) + O2(g) = 2H2O(1) △H = - 484 kJ·mol-1
B.H2O(g) = H2(g) +
O2(g) △H = + 242 kJ·mol-1
C.H2(g) +
O2(g) = H2O(g) △H = + 242 kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H = + 484 kJ·mol-1
难度: 简单查看答案及解析
-
下列热化学方程式中的 △ H 能表示物质燃烧热的是 ( )
A.2CO(g)+O2(g)=2CO2(g) △H=-556kJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1
D.H2(g)+Cl2(g)=3HCl(g) △H=-184.6kJ·mol-1
难度: 简单查看答案及解析
-
在一定温度下,反应A2(气)+B2(气)⇌2AB(气)达到平衡的标志是( )
A.单位时间生成n mol的A2同时生成n mol的AB
B.容器内的总压强不随时间变化
C.单位时间生成2n mol的AB同时生成n mol的B2
D.单位时间生成n mol的A2同时生成n mol的B2
难度: 中等查看答案及解析
-
已知某可逆反应:mA(g)+nB(g)
pC(g) △H="Q" kJ·mol-1,在密闭容器中进行,下图表示在不同时间t、温度T、压强P与反应物B的百分含量的关系曲线,下列判断正确的是
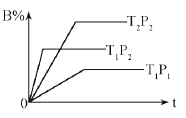
A.T1<T2 P1>P2 m+n>p ΔΗ<0
B.T1>T2 P1<P2 m+n<p ΔΗ>0
C.T1<T2 P1>P2m+n<p ΔΗ<0
D.T1 >T2 P1<P2m+n>p ΔΗ>0
难度: 简单查看答案及解析