-
下列有关物质性质与用途具有对应关系的是
A. FeSO4具有氧化性,可用作食品抗氧化剂
B. SiO2熔点高、硬度大,可用于制光学仪器
C. Al(OH)3具有弱碱性,可用于制胃酸中和剂
D. NH3具有还原性,可用作制冷剂
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和的FeCl3溶液中
B
由MgCl2溶液制备无水MgCl2
将MgCl2溶液加热蒸干
C
除去Cu粉中混有的CuO
加入稀硝酸溶液,过滤、洗涤、干燥
D
比较水和乙醇中氢的活泼性
分别将少量钠投入到盛有水和乙醇的烧杯中
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
ClO2是一种新型水处理剂,工业上用NaClO2与盐酸反应制备ClO2的反应如下:
①5NaClO2+4HCl(稀)===5NaCl+4ClO2↑+2H2O;
②NaClO2+4HCl(浓)===NaCl+2Cl2↑+2H2O。
下列说法中正确的是( )
A.两种反应中HCl均是还原剂
B.盐酸浓度越大,还原性越强
C.①中氧化产物与还原产物物质的量之比为4∶5
D.②中每生成1 mol Cl2转移2 mol电子
难度: 中等查看答案及解析
-
下列有关说法错误的是( )
A.成语“百炼成钢”、“蜡炬成灰”中均包含了化学变化
B.常温下,成语“金戈铁马”中的金属能溶于浓硝酸
C.谚语“雷雨肥庄稼”,其过程中包含了氧化还原反应
D.《荷塘月色》中“薄薄的青雾浮起在荷塘里”中的“青雾”属于胶体
难度: 简单查看答案及解析
-
下列各组变化中,前者是物理变化,后者是化学变化的是( )
A.碘的升华、石油的分馏
B.NH4Cl溶液除铁锈、食盐水导电
C.蛋白质溶液中加饱和(NH4)2SO4溶液、蓝色的胆矾常温下变白
D.热的饱和KNO3溶液降温析出晶体、二硫化碳洗涤试管内壁上的硫
难度: 简单查看答案及解析
-
同温同压下,m g甲气体和2m g乙气体所占体积之比为1∶2,根据阿伏加德罗定律判断,下列叙述不正确的是( )
A. 甲与乙的相对分子质量之比为1∶1
B. 同温同压下,甲和乙的密度之比是1∶1
C. 同温同体积下,等质量的甲和乙的压强之比是1∶1
D. 等质量的甲和乙中的原子数之比是1∶1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
B.能使酚酞变红的溶液中:Na+、Cu2+、CO32-、NO3-
C.0.1 mol·L-1 FeCl3溶液中:K+、NH4+、I-、SCN-
D.加入铝粉能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42-
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下不能实现的是( )
A.NH3
NO
HNO3
B.浓盐酸
Cl2
漂白粉
C.Al2O3
AlCl3(aq)
无水AlCl3
D.葡萄糖
C2H5OH
CH3CHO
难度: 简单查看答案及解析
-
取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属元素的化合价为( )
A.+aM/(22.4m) B.+am/(11.2M) C.+11.2m/(aM) D.+aM/(11.2m)
难度: 中等查看答案及解析
-
下列溶液中,溶质的物质的量浓度不是1 mol·L-1的是( )
A.10g NaOH固体溶解在水中配成250mL溶液
B.将80g SO3溶于水并配成1L的溶液
C.将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标况下,将22.4L氯化氢气体溶于水配成1L溶液
难度: 简单查看答案及解析
-
下列化学反应的离子方程式正确的是
A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合产生沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O
B.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
C.NH4HCO3溶液与过量NaOH溶液共热:NH4++OH-
NH3↑+H2O
D.浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+
Fe3++3NO2↑+3H2O
难度: 困难查看答案及解析
-
依据元素周期律进行推断,下列不正确的是( )
A.原子半径:Cl<S B.氧化性:Cl2>S
C.稳定性:HBr>HI D.酸性:HCl>HF
难度: 简单查看答案及解析
-
下列物质中所有原子最外层达到8电子稳定结构的化合物是( )
A.NH3 B.P4 C.PCl5 D.CCl4
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是
A.1molCl2与足量Fe反应,转移的电子数为3NA
B.在反应KIO3+6HI=3I2+KI+3H2O中,每生成3molI2转移电子数为5NA
C.向FeI2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移电子的数目为NA
D.1molCl2参加反应转移电子数一定为2NA
难度: 中等查看答案及解析
-
关于反应过程中的先后顺序,下列评价正确的是
A.向浓度都为0.1mol/L的FeCl3和CuCl2加入铁粉,溶质CuCl2首先与铁粉反应
B.向过量的Ba(OH)2溶液中滴加少量的KAl(SO4)2溶液,开始没有白色沉淀生成
C.向浓度都为0.1mol/L 的Na2CO3和NaOH的混合溶液通入CO2气体,NaOH首先反应
D.向浓度为0.1mol/L的FeCl3溶液中,加入质量相同、颗粒大小相同的铁和铜,铜单质首先参加反应
难度: 中等查看答案及解析
-
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
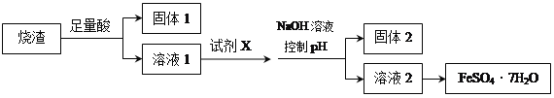
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 中等查看答案及解析
-
化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的有( )
①用电子式表示HCl的形成过程:
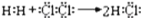
②MgCl2的电子式:
③质量数为133、中子数为78的铯原子:
Cs
④乙烯、乙醇结构简式依次为:CH2=CH2、C2H6O ⑤S2﹣的结构示意图:

⑥次氯酸分子的结构式:H-O-Cl ⑦CO2的分子模型示意图:
A.3个 B.4个 C.5个 D.6个
难度: 中等查看答案及解析
-
同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2②NO2和O2③NH3和
现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为
、
、
,则下列关系正确的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
同一短周期元素甲、乙、丙、丁原子序数依次增大。常温下,含甲的化合物r浓度为0.1mol·L-1时溶液pH=13。同周期元素简单离子中,乙离子的半径最小。p和q分别是元素丙和丁的单质,其中p为浅黄色固体。上述物质的转化关系如图所示(产物水已略去)。下列说法不正确的是

A.原子半径的大小关系:甲>乙>丙>丁
B.反应②的离子方程式为:C12+H2O
H++C1-+HC1O
C.m、n的阴离子在酸性条件下不能大量共存
D.甲、乙、丁的最高价氧化物对应水化物两两之间均可以发生反应
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。下列说法正确的是
A.常温常压下X的单质为气态
B.Z的氢化物为离子化合物
C.Y和Z形成的化合物的水溶液呈碱性
D.W与Y具有相同的最高化合价
难度: 中等查看答案及解析
-
合成氨及其相关工业中,部分物质间的转化关系如下图所示,下列说法不正确的是
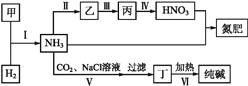
A. 甲、乙、丙三种物质中都含有氮元素
B. 反应Ⅰ、Ⅱ、Ⅲ中含氮元素的反应物都被氧化
C. Ⅴ中发生反应:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl
D. Ⅵ利用丁物质受热易分解的性质
难度: 中等查看答案及解析
-
下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是
A.氯气 二氧化碳 氢氧化钠 B.氯化钠 氦气 氢氧化钠
C.氯化钠 过氧化钠 氯化铵 D.氯化钠 过氧化氢 氯化铵
难度: 简单查看答案及解析
-
某无色溶滚中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种.为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是
A. 肯定存在NH4+、Cl﹣、Br﹣
B. SO42﹣、SO32﹣至少含有一种
C. 是否存在Na+需要通过焰色反应来确定
D. 肯定不存在Ba2+、Cu2+、SO32﹣、CO32﹣
难度: 困难查看答案及解析
-
2.56克Cu完全溶于一定量的浓HNO3中,生成的气体恰好充满500mL的烧瓶,然后将该烧瓶倒置于水中,缓缓通入一定量的氧气后容器内刚好充满水,则通入的氧气为( )
A.0.16g B.0.02mol C.0.224g D.0.32g
难度: 中等查看答案及解析
-
2.8gFe全部溶于一定浓度200mL的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1。若反应前后溶液体积变化忽略不计,则下列说法正确的是( )
A.反应后溶液中存在Fe3+和Fe2+ B.反应后的溶液最多还能溶解1.82g Fe
C.反应后溶液中c(NO3-)=0.75mol/L D.1.12L气体是NO、NO2的混合气体
难度: 中等查看答案及解析