-
化学与生活、社会发展息息相关,下列有关说法正确的是( )
A.“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”。“薪柴之灰”与铵态氮肥混合施用可增效。
B.玻璃钢和压电陶瓷都属于新型无机非金属材料。
C.硬化油又叫人造脂肪,便于储存和运输,但容易被空气氧化变质
D.高铁酸钾(K2FeO4)在水处理过程中涉及的变化过程有:蛋白质的变性、胶体聚沉、盐类水解、氧化还原反应。
难度: 简单查看答案及解析
-
下列所示物质的工业制备方法合理的是( )
A.制Si:SiO2
SiCl4
Si
B.制H2SO4:黄铁矿
SO2
H2SO3
H2SO4
C.卤水中提取Mg:卤水( 主要含MgCl2)
Mg(OH)2
MgCl2
Mg
D.侯氏制碱法:饱和食盐水
NaHCO3(s)
Na2CO3
难度: 简单查看答案及解析
-
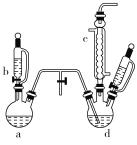
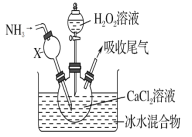
下列实验方案正确且能达到相应实验预期目的的是
A.分离乙醇和水
 B.蒸发氯化铝溶液得到氯化铝晶体
B.蒸发氯化铝溶液得到氯化铝晶体 C.用自来水制取少量蒸馏水
C.用自来水制取少量蒸馏水 D.实验室制取少量乙酸乙酯
D.实验室制取少量乙酸乙酯
难度: 中等查看答案及解析
-
根据下列实验能得出相应结论的是
选项
实验
结论
A
常温下,测得0.1 mol/LNaA溶液的pH小于0.1 mol/L Na2CO3溶液的pH
酸性:HA>H2CO3
B
向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色
还原性:I->Fe2+
C
向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变
Ksp(CuS)<Ksp(FeS)
D
向氨水中滴加少量AgNO3溶液,无沉淀生成
Ag+与NH3·H2O能大量共存
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法中正确的有几个
①12.0 g熔融的NaHSO4中含有的阳离子数为0.2NA
②1mol Na2O 和Na2O2混合物中含有的阴、阳离子总数是3 NA
③常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6 NA
④7.8 g
中含有的碳碳双键数目为0.3 NA
⑤用1L1.0 mol/LFeCl3溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为NA
⑥1mol SO2与足量O2在一定条件下充分反应生成SO3,共转移2 NA个电子
⑦在反应KIO3+6HI=KI+3I2+3H2O 中,每生成3molI2转移的电子数为5 NA
⑧常温常压下,17 g甲基(-CH3)中所含的中子数为9 NA
A. 3 B. 4 C. 5 D. 6
难度: 困难查看答案及解析
-
科学家从腐败草中提取出一种能使血液不凝固的双豆香素M,M的结构简式如图所示。下列说法正确的是( )
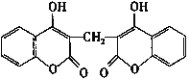
A.M分子有3种含氧官能团
B.M分子中所有原子可能处于同一平面
C.M分子中苯环上的一氯代物有4种
D.M能使溴水、酸性高锰酸钾溶液褪色,其褪色原理相同
难度: 简单查看答案及解析
-
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是( )
选项
条件
离子组
离子共存判断及离子方程式
A
滴加氨水
Na+、Fe3+、Cl-、NO3-
能大量共存
B
由水电离出c(H+)=1×10-13 mol·L-1
K+、NH4+、Cl-、AlO2-
能大量共存
C
pH=1的溶液
Fe3+、NH4+、I-、SO42-
不能大量共存,2Fe3++2I-=2Fe2++I2
D
通入少量SO2气体
K+、Na+、ClO-、SO42-
不能大量共存,
2ClO-+SO2+H2O=2HClO+SO32-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
W、X、Y、Z是原子序数依次增大的四种短周期主族元素,X与Y位于同一主族,X与W能够形成多种化合物,其中一种为红棕色气体,Y与Z形成的一种化合物Y2Z2的分子结构模型为
 。下列叙述正确的是( )
。下列叙述正确的是( )A.X与W、Y及Z均能组合成多种化合物 B.简单离子半径:Y>Z>X>W
C.W的氧化物的水化物一定为强酸 D.化合物Y2Z2中Y不满足8电子稳定结构
难度: 简单查看答案及解析
-
我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )
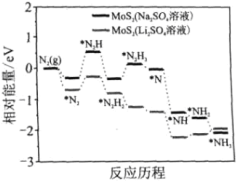
A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
难度: 中等查看答案及解析
-
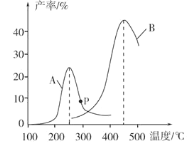
恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )
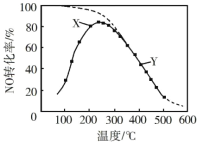
A.反应2NO(g) + O2(g) = 2NO2(g)的∆H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×10−4 mol·L−1,NO 平衡转化率为 50%,则平衡常数 K=2000
难度: 简单查看答案及解析
-
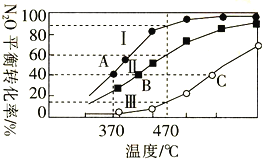
已知298K时,Ksp(NiS)=1.0×10-21,Ksp(NiCO3)=1.0×10-7 ;p(Ni)=-lg c(Ni2+),p(B)=-lg c(S2-)或-lg c(CO32-)。在含物质的量浓度相同的Na2S和Na2CO3的混合溶液中滴加Ni(NO3)2溶液产生两种沉淀,溶液中阳离子、阴离子浓度关系如图所示。下列说法错误的是( )
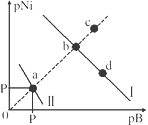
A. 对于曲线I,在b点加热,b点向c点移动
B. 常温下NiCO3的溶解度大于NiS的溶解度
C. 向d点对应的溶液中加入对应阴离子的钠盐,d点向b点移动
D. P为3.5且对应的阴离子是CO32-
难度: 困难查看答案及解析
-
已知pC=-lgc(B),室温下,某二元酸(H2A)中部分微粒的pC值随溶液pH值变化关系如图所示。下列说法错误的是( )

A.曲线a表示的微粒是H+
B.溶液中水的电离程度:m>n
C.pH=8时,溶液中,c(HA-)>c(H2A)
D.pH=1与pH=3时,H2A的浓度几乎相同
难度: 中等查看答案及解析
-
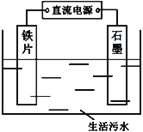
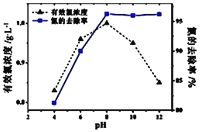
目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N 为离子交换膜。下列说法正确的是
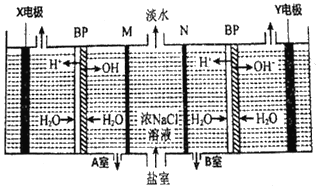
A.X 电极为电解池的阴极,该电极反应式为: 2H+-2e-=H2↑
B.电子流向: 电源负极→X电极→Y 电极→电源正极
C.电路中每转移1mol 电子,X、Y两极共得到标准状况下16.8L的气体
D.M为阳离子交换膜,A室获得副产品NaOH; 若去掉B室双极膜,B室产物不变
难度: 中等查看答案及解析
-
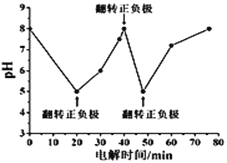
向0.1mol/I.的NH4HCO3溶液中逐渐加入0.1mol/LNaOH溶液时,含氮、含碳粒子的分布情况如图所示(纵坐标是各粒子的分布系数,即物质的量分数)。根据图象,下列说法不正确的是( )
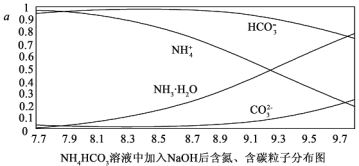
A. 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O
B. 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应
C. pH=9.5时,溶液中c(HCO3-)>c(NH3•H2O)>c(NH4+)>c(CO32-)
D. 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3
难度: 困难查看答案及解析
-
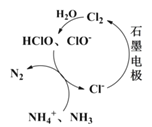
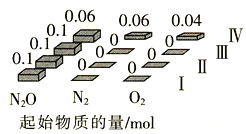
《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是( )
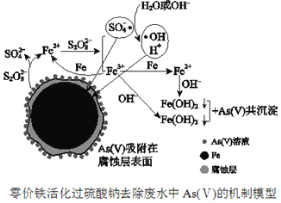
A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56g Fe参加反应,共有NA个
被还原
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中c(Fe3+)为1×10-10mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
难度: 中等查看答案及解析