-
下列过程中没有发生电子转移的是( )
A.液氨作制冷剂 B.合成氨 C.大气固氮 D.生物固氮
难度: 中等查看答案及解析
-
下列石油的分馏产品中,沸点最低的是( )
A.汽油 B.煤油 C.凡士林 D.石油气
难度: 中等查看答案及解析
-
生铁比纯铁( )
A.硬度低 B.易腐蚀 C.熔点高 D.含碳量低
难度: 中等查看答案及解析
-
用化学用语表示 NH3+ HCl
NH4Cl中的相关微粒,其中正确的是( )
A. 中子数为8的氮原子:
B. HCl 的电子式:
C. NH3的结构式:
D. Cl−的结构示意图:
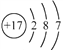
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是( )
A.碘升华 B.蔗糖溶于水 C.氯化氢溶于水 D.氢氧化钠熔化
难度: 中等查看答案及解析
-
将等量的固体Mg(OH)2,置于等体积的下列液体中,最终固体剩余最少的是( )
A.在纯水中 B.在0.1mol/L的MgCl2溶液中
C.在0.1mol/L的NH3·H2O中 D.在0.1mol/L的CH3COOH溶液中
难度: 中等查看答案及解析
-
如图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )

A.硝酸铵 B.生石灰
C.氯化铵 D.食盐
难度: 中等查看答案及解析
-
同温同压下,两种气体的体积如果不相同,其主要原因是气体的( )
A.分子大小不同 B.分子间的平均距离不同
C.化学性质不同 D.物质的量不同
难度: 中等查看答案及解析
-
下列不符合安全规范的是( )
A.金属钠着火时使用泡沫灭火器灭火
B.NH3泄露时向空中喷洒水雾
C.含Cl2的尾气用碱溶液处理后再排放
D.面粉生产车间应严禁烟火
难度: 中等查看答案及解析
-
埋在地下的钢管常用如图所示方法加以保护,使其免受腐蚀,下列说法正确的是( )
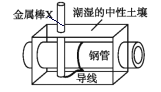
A.金属棒X的材料可能为钠
B.金属棒X的材料可能为铜
C.钢管附近土壤的pH增大
D.这种方法称为外加电流的阴极保护法
难度: 中等查看答案及解析
-
如图,甲烷与氯气在光照条件下反应,不涉及的实验现象是( )
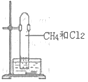
A.气体的黄绿色变浅至消失 B.试管内壁上有油珠附着
C.试管内水面上升 D.试管内有白烟生成
难度: 简单查看答案及解析
-
下列装置中,不添加其他仪器无法检查气密性的是( )
A.
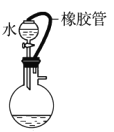 B.
B.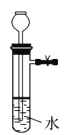 C.
C.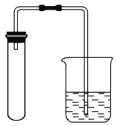 D.
D.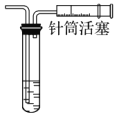
难度: 中等查看答案及解析
-
用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量 B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3Hg D.“白毛”是氧化铝
难度: 中等查看答案及解析
-
将0.1 mol/L CH3COOH溶液加水稀释或加入少量CH3COONa晶体时,都会引起( )
A.溶液的pH增大
B.CH3COOH电离度增大
C.溶液的导电能力减弱
D.溶液中c(OH-)减小
难度: 简单查看答案及解析
-
关于CaF2的表述正确的是( )
A.构成的微粒间仅存在静电吸引作用 B.熔点低于CaCl2
C.与CaC2所含化学键完全相同 D.在熔融状态下能导电
难度: 中等查看答案及解析
-
某次硫酸铜晶体结晶水含量的测定实验中,相对误差为+2.7%,其原因不可能是( )
A.实验时坩埚未完全干燥 B.加热后固体未放入干燥器中冷却
C.加热过程中晶体有少量溅失 D.加热后固体颜色有少量变黑
难度: 中等查看答案及解析
-
探究浓硫酸和铜的反应,下列装置或操作正确的是( )
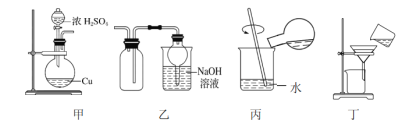
A.装置甲进行铜和浓硫酸的反应
B.装置乙收集二氧化硫并吸收尾气
C.装置丙稀释反应后的混合液
D.装置丁分离稀释后混合物中的不溶物
难度: 中等查看答案及解析
-
实验测得浓度均为0.5 mol•L-1的Pb(CH3COO)2溶液的导电性明显弱于Pb(NO3)2溶液,又知PbS是不溶于水及稀酸的黑色沉淀,下列离子方程式书写错误的是
A.Pb(NO3)2溶液与 CH3COONa 溶液混合:Pb2++2CH3COO-= Pb(CH3COO)2
B.Pb(NO3)2 溶液与K2S溶液混合:Pb2++S2-=PbS↓
C.Pb(CH3COO)2 溶液与K2S溶液混合:Pb2++S2- =PbS↓
D.Pb(CH3COO)2 在水中电离: Pb(CH3COO)2
Pb2+ +2CH3COO-
难度: 中等查看答案及解析
-
第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是( )
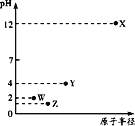
A.Y可能是硅元素
B.简单离子半径:Z>W>X
C.气态氢化物的稳定性:Y>W
D.非金属性:Y>Z
难度: 中等查看答案及解析
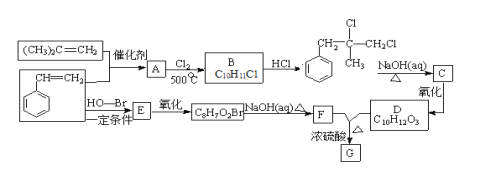
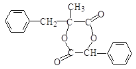
 )
)