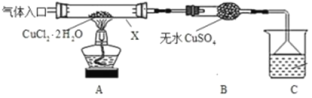
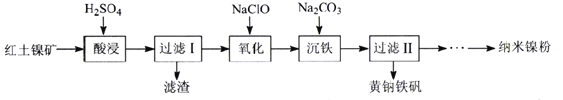
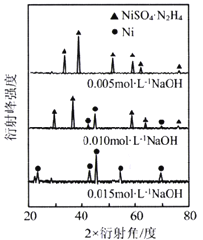
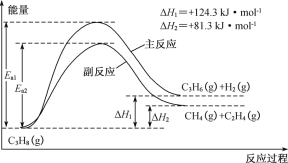
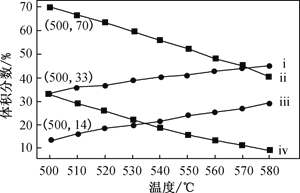
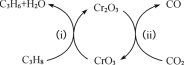
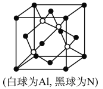
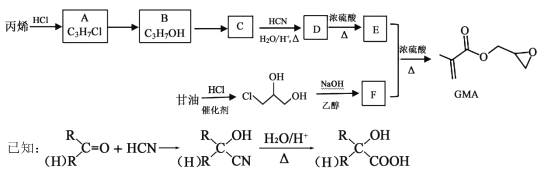
-
化学与社会、生活密切相关,下列解释错误的是
实际应用
原理解释
A
含Na2CO3的盐碱地可用石膏降低其碱性
CaSO4具有酸性
B
二氧化硫用于纸的增白
二氧化硫具有漂白性
C
不可食用的“地沟油”可用于制肥皂
油脂碱性条件下可水解
D
小苏打用于焙制糕点的发酵粉
NaHCO3受热易分解产生气体
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。下列说法错误的是
A.普通玻璃含有二氧化硅 B.该发电玻璃能将光能完全转化为电能
C.碲化镉是一种无机化合物 D.应用该光电转化技术可减少温室气体排放
难度: 简单查看答案及解析
-
按第26届国际计量大会重新定义,阿伏加德罗常数(NA)有了准确值6.02214076×1023。下列说法正确的是
A.18g T2O中含有的中子数为12NA
B.用23.5g AgI与水制成的胶体中胶体粒子数目为0.1NA
C.在标准状况下,80g SO3所占的体积约为22.4L
D.1mol某烷烃CnH2n+2(n≥1)分子中含有的共价键数为 (3n+1)NA
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期元素,X原子的质子数等于Z与Y的质子数之和;Z与Y位于同一周期;Y2常用做保护气,一般由分馏液态空气得到;非金属Z的一种固体单质可导电;W原子半径是短周期元素中最大的。下列说法正确的是( )
A. 四种元素中简单离子半径由大到小的顺序W、X、Y、Z
B. X、Z、W的最高价氧化物的水化物可两两发生反应
C. 氢化物沸点最高的是Z的氢化物
D. 随着温度升高,Y2的化学活性增强,可能与W单质发生化学反应
难度: 中等查看答案及解析
-
某有机物的结构简式如下图所示,下列有关该有机物的说法正确的是( )
A. 该有机物的化学式为C10H14
B. 它的一氯代物有6种
C. 该有机物分子中所有碳原子一定在同一平面上
D. 一定条件下,它可以发生取代、 加成和氧化反应
难度: 简单查看答案及解析
-
电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和Li4Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是( )

A. 当B外接电源负极时,膜由无色变为蓝色
B. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4eˉ=Li4Fe4[Fe(CN)6]3
C. 当A接电源的负极时,此时Li+得到电子被还原
D. 当A接电源正极时,膜的透射率降低,可以有效阻挡阳光
难度: 中等查看答案及解析
-
已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是
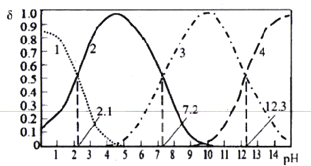
A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
难度: 中等查看答案及解析