-
下列设计的实验方案能达到相应实验目的的是
选项
实验目的
实验方案
A
证明反应速率会随反应物浓度的增大而加快
用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·L−1CuSO4溶液,迅速产生较多气泡
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀硝酸后,滴加KSCN溶液,观察溶液是否变红
C
证明“84”消毒液的氧化能力随溶液pH的减小而增强
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色
D
证明氯化银的溶解度大于硫化银的溶解度
向2mL 0.1mol·L−1硝酸银溶液中加入1mL 0.1
mol·L−1 NaCl溶液,出现白色沉淀,再加入几滴0.1mol·L−1的Na2S溶液,有黑色沉淀生成
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
化学与社会、生活、生产密切相关,下列有关说法中正确的是( )
A.漂白粉溶液可用于夏天游泳池杀菌消毒
B.菜刀洗净后擦干是为了防止发生化学腐蚀
C.区分食盐是否加碘的方法是向食盐溶液中加少量淀粉,观察其是否变蓝
D.安装煤燃烧过程的固硫“装置,主要是为了提高煤的利用率
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数的数值,下列说法正确的是( )
A.在标准状况下,11.2L HF含有的分子数目为0.5NA
B.常温常压下,17g甲基(-14CH3)所含的中子数为9NA
C.17gH2O2中含有非极性健的数目为NA
D.13.8gNO2与足量水反应,转移的电子数为0.2NA
难度: 简单查看答案及解析
-
螺环烃是指分子中两个碳环共用一个碳原子的脂环烃。
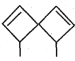 是其中的一种。下列关于该化合物的说法正确的是
是其中的一种。下列关于该化合物的说法正确的是A.该化合物的分子式为C10H12 B.一氯代物有五种
C.所有碳原子均处于同一平面 D.与HBr以物质的量之比1:1加成生成二种产物
难度: 中等查看答案及解析
-
用氟硼酸(HBF4,属于强酸)代替硫酸做铅蓄电池的电解质溶液,可使铅蓄电池在低温下工作时的性能更优良,反应方程式为:Pb+PbO2+4HBF4
2Pb(BF4)2+2H2O;Pb(BF4)2为可溶于水的强电解质,下列说法正确的是
A. 放电时,正极区pH增大
B. 充电时,Pb电极与电源的正极相连
C. 放电时的负极反应为:PbO2+4H++2e-=Pb2++2H2O
D. 充电时,当阳极质量增加23.9g时,溶液中有0.2 mole-通过
难度: 中等查看答案及解析
-
常温下,向20mL 0.1 mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
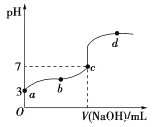
A.c点对应的V(NaOH)<20mL
B.a点表示的溶液中由水电离出的H+浓度为1.0
10-11mol·L-1
C.b点表示的溶液中 c(CH3COO -)>c(Na+)
D.b、d点表示的溶液中c(CH3COO-)与c(CH3COOH)的比值相等
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质的混合物中通入Z的气体单质,得到化合物甲和化学式为WX的常见可燃性有毒气体乙,乙燃烧火焰呈蓝色;②在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛,下列说法不正确的是( )
A.非金属性:Z>X>W B.W与Z形成的化合物可用于工业上的重要有机溶剂
C.简单离子半径:Z>X>Y D.ZX2具有强氧化性,可用于饮用水消毒
难度: 中等查看答案及解析

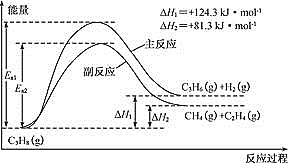
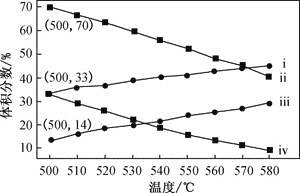
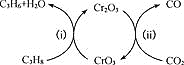
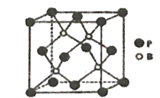
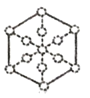
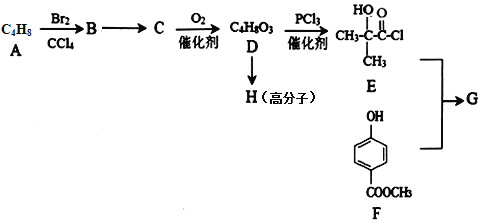
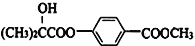 ;
; 。
。