-
用下列实验装置进行相应实验,能达到实验目的的是
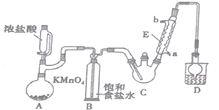
A. 用装置甲进行中和热的测定
B. 用装置乙制取 CO2 气体
C. 用装置丙比较KMnO4、Cl2、S的氧化性强弱
D. 用装置丁模拟工业制氨气并检验产物
难度: 中等查看答案及解析
-
对氨基苯甲酸可用甲苯为原料合成。已知①苯环上的硝基可被还原为氨基:
+3Fe+6HCl→
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化;②-CH3为邻、对位取代定位基,而-COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是
A. 甲苯
X
Y
对氨基苯甲酸
B. 甲苯
X
Y
对氨基苯甲酸
C. 甲苯
X
Y
对氨基苯甲酸
D. 甲苯
X
Y
对氨基苯甲酸
难度: 困难查看答案及解析
-
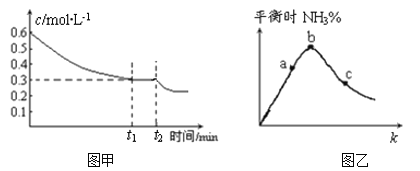
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)
2NH3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如下表所示:
容器编号
起始时各物质的物质的量/mol
达平衡时体系能量的变化
N2
H2
NH3
①
1
3
0
放出热量:23.15 kJ
②
0.9
2.7
0.2
放出热量:Q
下列叙述错误的是
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器①的体积为0.5 L,则平衡时放出的热量小于23.15 kJ
难度: 困难查看答案及解析
-
在一定条件下CO(g)和H2(g)发生反应:CO(g)+2H2(g)
CH3OH(g)。在容积固定且均为1L的a、b、c三个密闭容器中分别充入1mol CO(g)和2mol H2(g),三个容器的反应温度分别为T1、T2、T3(依次升高)且恒定不变,测得反应均进行到5min时CH3OH(g)的浓度如下图所示。下列说法正确的是
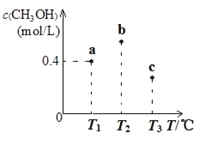
A.a容器中,0~5min时平均反应速率ν(H2)=0.04mol/(L·min)
B.反应均进行到5min时,三个容器中一定达到化学平衡状态的是b
C.当三个容器内的反应都达到化学平衡时,CO转化率最大的是a
D.保持温度和容积不变,若开始时向b容器中充入0.6mol CO(g)、1.2mol H2(g)和0.4mol CH3OH(g),则反应开始时ν(正)< ν(逆)
难度: 困难查看答案及解析
-
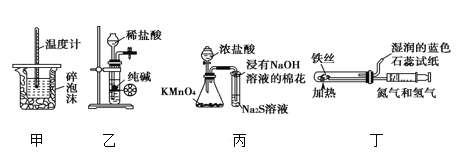
下列实验操作中,对应的实验现象以及实验结论都正确,且两者具有因果关系的是( )
选项
实验操作
实验现象
实验结论
A
向稀硝酸中加入过量铁粉,充分反应后,再滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe 氧化为Fe3+
B
将少量铜粉加入1.0mol/L
Fe2(SO4)3溶液中
固体溶解,溶液变蓝色
金属铁比铜活泼
C
0.1 mol/L MgSO4溶液中滴加过量NaOH 溶液,再滴加
0.1 mol/L CuSO4溶液
先生成白色沉淀,后变为浅蓝色沉淀
Cu(OH)2溶度积比Mg(OH)2小
D
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
金属铝熔化而不滴落下来
金属铝熔点比氧化铝低
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
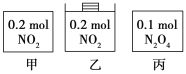
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
难度: 困难查看答案及解析
-
H3BO3(一元弱酸)可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
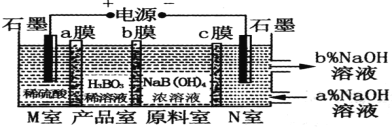
A.M室发生的电极反应式为:2H2O-4e- =O2↑+4H+
B.N室中:a%<b%
C.b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D.理论上每生成1mol产品,阴极室可生成标准状况下5.6 L气体
难度: 困难查看答案及解析
-
在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”,凡有一个手性碳原子的物质一定具有光学活性。已知某有机物结构如下:具有光学活性,当它发生下列反应后生成的有机物仍然具光学活性的是
A. 与NaOH溶液共热 B. 与甲酸发生酯化反应
C. 与氧气发生催化氧化 D. 在催化剂存在下与H2作用
难度: 中等查看答案及解析
-
用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为( )
A. 0.4 mol B. 0.5 mol C. 0.6 mol D. 0.8 mol
难度: 困难查看答案及解析
-
某混合物里有一种饱和一元醇和一种饱和一元醛共6 g,和足量银氨溶液反应后,还原出32.4 g银,下列说法正确的是( )
A.混合物中的醛不一定是甲醛
B.混合物中醇与醛的质量之比为5∶3
C.混合物中的醇只能是乙醇
D.混合物中醇与醛的质量之比为1∶3
难度: 困难查看答案及解析
-
以下10种实验操作方法以及结论错误的有几种:
①比较水和乙醇羟基的活泼性强弱,用金属钠分别与水和乙醇反应。
②欲证明CH2=CHCHO中含有碳碳双键,滴入酸性KMnO4溶液,看紫红色是否褪去。
③欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸、氢氧化钠、酸碱指示剂。
④将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是否为还原性糖
⑤向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)﹤Ksp(BaSO4)。
⑥检验溴乙烷中的溴元素,将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液。
⑦用燃烧的方法鉴别乙醇、四氯化碳、苯。
⑧用足量的NaOH溶液与矿物油和地沟油加热,可鉴别出地沟油。
⑨油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油分离。
⑩将铜丝在酒精灯外焰上加热变黑后再移至内焰,铜丝恢复原来的红色
A. 3 B. 4 C. 5 D. 6
难度: 困难查看答案及解析
-
钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料 (NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理 为Na1-mCoO2+NamCn
NaCoO2+Cn。下列说法不正确的是
A.放电时,Na+向正极移动
B.放电时,负极的电极反应式为NamCn—me-=mNa++Cn
C.充电时,阴极质量减小
D.充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
难度: 困难查看答案及解析
-
将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积V L。则下列说法正确的是
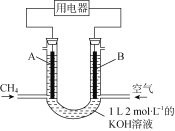
A.OH-由A端移向B端
B.0<V≤22.4 L时,电池总反应的化学方程式为CH4 +2O2 +KOH=KHCO3 +2H2O
C.22.4 L<V≤44.8 L时,负极电极反应为:CH4 +9CO32-+3H2O-8e-=10HCO3-
D.V=33.6 L时,溶液中阴离子浓度大小关系为c(CO32-)>c(HCO3-)>c(OH-)
难度: 困难查看答案及解析
-
某恒定温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(?)+2D(?),“?”代表状态不确定。5 min后达到平衡,测得生成1.6 mol C,且反应的前后压强之比为15∶14,则下列说法正确的是
A.该反应的化学平衡常数表达式是K=
B.0~5 min内A的反应速率为0.24 mol·L-1·min-1
C.此时B的平衡转化率是40%
D.增大该体系的压强,平衡向右移动,化学平衡常数增大
难度: 困难查看答案及解析
-
网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除
 外,还有( )
外,还有( )
A.7种 B.11种 C.16种 D.17种
难度: 中等查看答案及解析
-
常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)与溶液pH的变化关系如图所示。已知:H2C2O4
HC2O4-+H+ Ka1;HC2O4-
C2O42-+H+ Ka2。则下列说法正确的是

A.当pH=3时,溶液中c(HC2O4-)<c(C2O42-)=c(H2C2O4)
B.pH由3增大到5.3的过程中,水的电离程度逐渐减小
C.常温下,Ka2=10-5.3
D.常下随着pH的增大:c2(HC2O4-)/[c(H2C2O4)c(C2O42-)] 的值先增大后减小
难度: 困难查看答案及解析


 澄清石灰水变浑浊
澄清石灰水变浑浊