-
常温下,向某浓度的H2C2O4溶液中逐滴加入已知浓度的NaOH溶液,若pC表示溶液中溶质微粒的物质的量浓度的负对数,则所得溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)与溶液pH的变化关系如图所示。已知:H2C2O4 HC2O4-+H+ Ka1;HC2O4-
HC2O4-+H+ Ka1;HC2O4- C2O42-+H+ Ka2。则下列说法正确的是
C2O42-+H+ Ka2。则下列说法正确的是

A.当pH=3时,溶液中c(HC2O4-)<c(C2O42-)=c(H2C2O4)
B.pH由3增大到5.3的过程中,水的电离程度逐渐减小
C.常温下,Ka2=10-5.3
D.常下随着pH的增大:c2(HC2O4-)/[c(H2C2O4)c(C2O42-)] 的值先增大后减小
-
pH是溶液中c(H+)的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)随着溶液pH的变化曲线如图所示。下列说法不正确的是( )
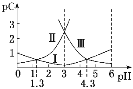
A. 曲线Ⅰ代表HC2O4-的浓度随着pH增大先变小后变大
B. 草酸的电离常数Ka1=1×10-1.3;Ka2=1×10-4.3
C. pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4)
D. c(C2O42-).c(H2C2O4)/c2(HC2O4-)=10-3
-
pH是溶液中c(H+)的负对数,若定义pc是溶液中溶质物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pc(H2C2O4)、pc(HC2O4-)、pc(C2O42-)随着溶液pH的变化曲线如图所示:己知草酸的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5 下列叙述正确的是( )
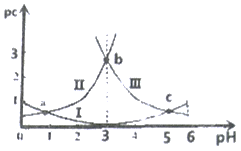
A. 曲线I表示H2C2O4的变化
B. pH=4时,c(HC2O4-)>c(C2O42-)
C. c(H2C2O4)+c(HC2O4-)+c(C2O42-)在a点和b点一定相等
D. 常温下,  随pH的升高先增大后减小
随pH的升高先增大后减小
-
25℃时,草酸溶液中部分微粒的物质的量浓度随NaOH溶液的加入pH 的变化如图所示。其中c (H2C2O4) +c (HC2O4-)+ c (C2O42-)=0.1mol/L,下列说法不正确的是
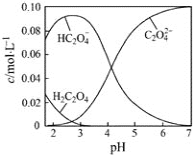
A. H2C2O4的Ka2数量级为10-5
B. NaHC2O4溶液中,c (Na+)>c(HC2O4-)>c (H+)>c (OH-)
C. 0.1mol/L 的H2C2O4溶液,H2C2O4的电离度为80%
D. pH=7.0的溶液中,c (Na+)=0.1 + c(C2O42-) - c (H2C2O4)
-
已知草酸为二元弱酸:H2C2O4 HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O C2O
C2O +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
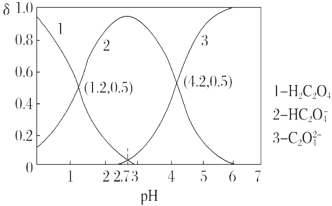
A. Ka1=10-1.2
B. pH=2.7时溶液中: =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
-
已知草酸为二元弱酸:H2C2O4 HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O C2O
C2O +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
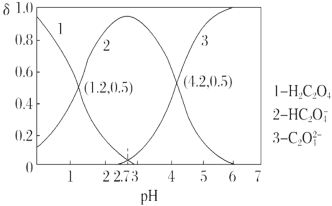
A. Ka1=10-1.2
B. pH=2.7时溶液中: =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
-
常温时下列各溶液中,微粒的物质的量浓度关系正确的是( )
A. 新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH-)
B. 25℃时,浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(CH3COO-) + 2c(OH-) = c(CH3COOH) + 2c(H+)
C. 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3 :1
D. pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
-
已知草酸为二元弱酸:H2C2O4⇌HC2O4-+H+ Ka1;HC2O4-⇌C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42−三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
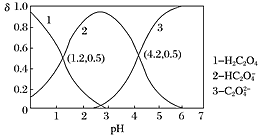
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4)
B.pH=2.7的溶液中: =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
-
常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )
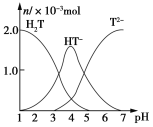
A. V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B. V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C. V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D. V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
-
H2C2O4为二元弱酸,20 ℃时,配制一组c(H2C2O4) + c(HC2O4-) + c(C2O42-)= 0.100mol/L的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )

A. pH = 2.5的溶液中:c(H2C2O4) +c(C2O42-) > c(HC2O4-)
B. c(Na+) = 0.100 mol/L的溶液中:c(H+) +c(H2C2O4) = c(C2O42-)+ c(OH-)
C. c(HC2O4-) = c(C2O42-)的溶液中:c(Na+) > 0.100 mol/L + c(HC2O4-)
D. pH = 7.0 的溶液中,2c(Na+) = c(C2O42-)
HC2O4-+H+ Ka1;HC2O4-
C2O42-+H+ Ka2。则下列说法正确的是





 =1000
=1000
 =1000
=1000

