-
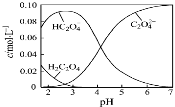
已知草酸为二元弱酸:H2C2O4⇌HC2O4-+H+ Ka1;HC2O4-⇌C2O42-+H+ Ka2。常温下,向某浓度的草酸溶液中逐滴加入一定物质的量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4—、C2O42−三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法不正确的是( )
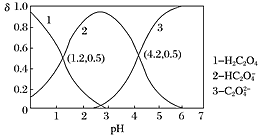
A.pH=1.2的溶液中:c(K+)+c(H+)=c(OH−)+c(H2C2O4)
B.pH=2.7的溶液中: =1000
=1000
C.向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离度一定增大
D.将相同物质的量的KHC2O4和K2C2O4固体完全溶于水所得混合液的pH为4.2
-
已知草酸为二元弱酸:H2C2O4 HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O C2O
C2O +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
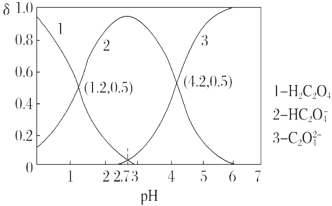
A. Ka1=10-1.2
B. pH=2.7时溶液中: =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
-
已知草酸为二元弱酸:H2C2O4 HC2O+H+ Ka1、HC2O
HC2O+H+ Ka1、HC2O C2O
C2O +H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O
+H+ Ka2。常温下,向某浓度的H2C2O4溶液中逐滴加入一定浓度的KOH溶液,所得溶液中H2C2O4、HC2O、C2O 三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
三种微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是( )
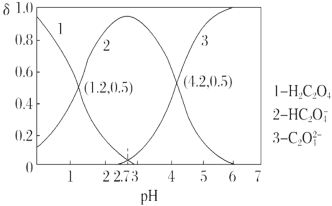
A. Ka1=10-1.2
B. pH=2.7时溶液中: =1000
=1000
C. 将相同物质的量的KHC2O4和K2C2O4固体完全溶于水便是配得pH为4.2的混合液
D. 向pH=1.2的溶液中加KOH溶液,将pH增大至4.2的过程中水的电离程度一直增大
-
H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2,Ka2 (H2C2O4 ) =5.4×10−5,设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A. 0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 )
B. c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ )
C. pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4)
D. c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−)
-
已知草酸为二元弱酸:H2C2O4 HC2O4-+ H+ Ka1; HC2O4-
HC2O4-+ H+ Ka1; HC2O4- C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
C2O42-+ H + Ka2,常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42-三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是()
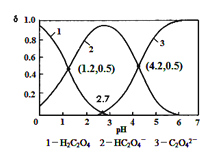
A.常温下,Ka1:Ka2=1000
B.将相同物质的量 KHC2O4和 K2C2O4固体完全溶于水可配得 pH 为 4.2 的混合液
C.pH=1.2溶液中:c(K +) + c(H +) = c(OH-) + c(H2C2O4)
D.向pH=1.2的溶液中加KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
-
草酸是二元弱酸,草酸氢钾溶液呈酸性.在0.01mol/L KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+)=c(HC2O4﹣)+c(OH﹣)+c(C2O42﹣ )
B.c(HC2O4﹣)+c(C2O42﹣)=0.01 molL﹣1
C.c(C2O42﹣ )<c(H2C2O4)
D.c(K+)=c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣ )
-
有机酸种类繁多,甲酸( HCOOH)是常见的一元酸,常温下其Ka=1.8×10-4,草酸(H2C2O4)是常见的二元酸,常温下,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 甲酸钠溶液中:c(Na+)>c(HCOOˉ)>c(H+)>c(OHˉ)
B. 草酸氢钠溶液中加入甲酸钠溶液至中性:c(Na+)=c(HC2O4ˉ)+2c(C2O42-)+c(HCOOˉ)
C. Na2C2O4溶液中;c(HC2O4ˉ)+c(H2C2O4)+c(H+)=c(OHˉ)
D. 足量甲酸与草酸钠溶液反应:2 HCOOH+Na2C2O4==H2C2O4+2 HCOONa
-
H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合的溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. pH=7的溶液中:c(Na+)= 2c(C2O42–)
C. c(HC2O4–)= c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+ c(HC2O4–)
D. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
-
H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC 2O4–)
2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
-
已知常温下某二元弱酸(H2R)电离常数为Ka1=5×10-7,Ka2=5.6×10-11,HClO的Ka=3.0×10-8,回答下列问题:
(1)常温下向NaClO溶液加入少量的H2R溶液发生反应的离子方程式为___________________
(2)常温下pH=3的HClO溶液浓度为C1,pH=4的HClO溶液浓度为C2,则C1____10C2(填“>”、“<”或“=”)
(3)常温下2mol/L的H2R溶液的pH约为_______________
(4)常温下0.1mol/L的NaHR溶液pH__________7(填“>”、“<”或“=”),溶液中的阴阳离子的浓度由大到小的顺序为___________________________________________
(5)常温下,向10 mL 0.1 mol/LH2R溶液中滴加0.1 mol·L-1的KOH溶液V mL
①若混合后的溶液中离子浓度有如下关系:c(K+)=2c(R2-)+c(HR-),V______10(填“>”、“<”或“=”)。
②当混合后的溶液中离子浓度有如下关系:c(K+) = c(R2-)+c(HR-)+c(H2R),则溶液中溶质为_____________,V______10(填“>”、“<”或“=”)。
③当V=30时,混合后的溶液中c(OH-)-c(H+)-c(HR-)-2c(H2R)=________mol/L。

=1000

 =1000
=1000
 =1000
=1000

