-
下列变化与盐类水解平衡无关的是
A. 盐酸与碳酸钙反应生成二氧化碳 B. 将饱和氯化铁溶液加入沸水制胶体
C. 热的纯碱溶液除油污 D. 配制硫酸亚铁溶液时加少量硫酸
难度: 中等查看答案及解析
-
下列有关溶液的说法中正确的是( )
A. 0.1 mol·L-1(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B. pH=4的醋酸稀释10倍,溶液中c(CH3COOH)、c(OH-)均减小
C. 向0.1 mol·L-1HF溶液中滴加NaOH溶液至中性,c(Na+)>c(F-)
D. pH=2的H2SO3溶液与pH=12的NaOH溶液以任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HSO3-)+2c(SO32-)
难度: 中等查看答案及解析
-
①pH=0的盐酸 ②0.5 mol·L-1的盐酸 ③0.1 mol·L-1的NH4Cl溶液 ④0.1 mol·L-1的NaOH溶液 ⑤0.5 mol·L-1的NH4Cl溶液,以上溶液中水电离出的c(H+)由大到小的顺序是
A.⑤③④②① B.①②③⑤④ C.①②③④⑤ D.⑤③④①②
难度: 简单查看答案及解析
-
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.足量AgCl固体置于同浓度的CaCl2和NaCl溶液,两溶液中银离子浓度相同
D.pH=5.6的CH3COOH与CH3COONa混合溶液,c(Na+)>c(CH3COO-)
难度: 中等查看答案及解析
-
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
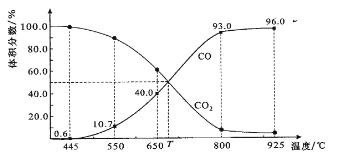
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,ʋ正,ʋ逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
难度: 困难查看答案及解析
-
已知在100℃的温度下,水的离子积KW=1×10-12。下列说法中正确的是( )
A.0.005 mol•L-1的硫酸溶液,pH=2
B.0.001 mol•L-1的氢氧化钠溶液,pH=11
C.0.005mol•L-1的硫酸溶液与0.01mol•L-1的氢氧化钠溶液等体积混合,混合溶液的pH为6,溶液显酸性
D.完全中和pH=3的硫酸溶液50mL,需要pH=11的NaOH溶液50mL
难度: 简单查看答案及解析
-
下列实验误差分析不正确的是
A.测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度差值Δt偏小
B.滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C.用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
难度: 中等查看答案及解析
-
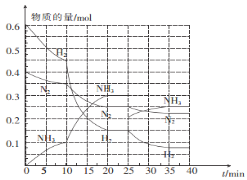
在容积一定的密闭容器中,置入一定量的一氧化氮和足量碳发生化学反应:C(s)+2NO(g)
CO2(g)+N2(g),平衡时c(NO)与温度T的关系如下图所示,则下列说法不正确的是

A. 该反应正反应的△H<0
B. 若状态A、B的逆反应速率分别为v逆(A)、v逆(B),则v逆(A)>v逆(B)
C. 在T2时,若反应体系处于状态D,则此时v正>v逆
D. 若状态B、C、D的压强分别为PB、PC、PD,则 PC>PD=PB
难度: 困难查看答案及解析
-
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A.
 B.
B.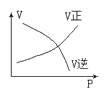
C.
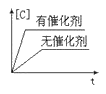 D.
D.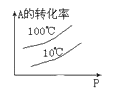
难度: 中等查看答案及解析
-
下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>10b
B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13mol/L,则此溶液一定呈酸性
C.25℃时,将pH=4的盐酸稀释10000倍后,溶液的pH大于7
D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10
难度: 中等查看答案及解析
-
在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
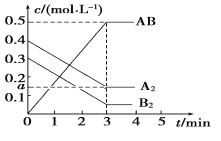
A.图中a点的值为0.15 B.该反应的平衡常数K=0.03
C.温度升高,平衡常数K值减小 D.平衡时A2的转化率为62.5%
难度: 中等查看答案及解析
-
某密闭容器中发生反应:X(g) + 3Y(g)
2Z(g) ΔH < 0。图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所变化,但都没有改变各物质的初始加入量。下列说法正确的是( )
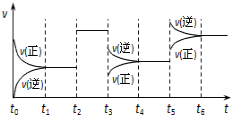
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内反应物转化率最低
难度: 中等查看答案及解析
-
化学在日常生活和生产中有着重要的应用。下列说法不正确的是( )
A. 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
B. 误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒
C. 含氟牙膏不能防治龋齿
D. 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
难度: 简单查看答案及解析
-
在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O
HS-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大 B. 加入CuSO4固体,HS-浓度减小
C. 升高温度,c(HS-)/c(S2-)减小 D. 加入NaOH固体,溶液pH减小
难度: 简单查看答案及解析
-
工业回收铅蓄电池中的铅,常用Na2CO3或NaHCO3溶液处理铅膏(主要成分PbSO4)获得PbCO3:PbSO4(s)+CO32-(aq)
PbCO3(s)+SO42-(aq) K=2.2×105。经处理得到的PbCO3灼烧后获得PbO,PbO再经一步转变为Pb。下列说法正确的是
A. PbSO4的溶解度小于PbCO3
B. 处理PbSO4后,Na2CO3或NaHCO3溶液的pH升高
C. 整个过程涉及一个复分解反应和两个氧化还原反应
D. 若用等体积、等浓度的Na2CO3和NaHCO3溶液分别处理PbSO4,Na2CO3溶液中的PbSO4转化率较大
难度: 中等查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/L NaOH 溶液滴定20mL 0.1mol/L H2A溶液的滴定曲线如图所示。下列说法正确的是
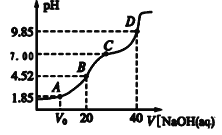
A.A点所得溶液中:V0<10mL
B.B点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C.C点所得溶液中:c(A2-)=c(Na+)-c(HA-)-c(H2A)
D.D点所得溶液中A2-水解平衡常数 Kh1=10-719
难度: 困难查看答案及解析