-
将钠投入下列溶液中,既有气体产生,又有沉淀生成的是
A. NaCl溶液 B. FeCl3溶液 C. 盐酸 D. Na2CO3溶液
难度: 简单查看答案及解析
-
某些补铁剂的成分中含有硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是
A. 稀盐酸 B. 石蕊溶液 C. KSCN溶液 D. 氯水
难度: 中等查看答案及解析
-
已知四氯化碳是一种无色有毒易挥发液体,不溶于水,密度>1 g/cm3,沸点约为76.8℃。要从水与四氯化碳的混合物里将四氯化碳分离出来,下列方法中最合理的是
A. 过滤 B. 分液 C. 蒸馏 D. 萃取
难度: 中等查看答案及解析
-
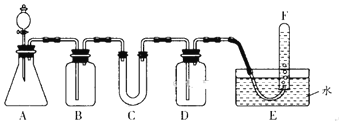
下列各图示中能较长时间看到Fe(OH)2白色沉淀的是


A.①②③ B.①②④ C.①②③④ D.②③④
难度: 中等查看答案及解析
-
1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.向含有 CaCO3沉淀的水中通入足量的CO2,沉淀不会溶解
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1∶1
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积不相同
D.分别向NaHCO3溶液和Na2CO3溶液中加入Ca(OH)2溶液,只有Na2CO3溶液产生沉淀
难度: 简单查看答案及解析
-
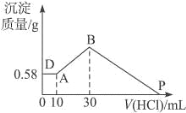
向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
B.AlCl3溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C.三氯化铁溶液中加入金属钠:3Na+Fe3+=3Na++Fe
D.NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
节日燃放的绚丽焰火与“焰色反应”知识相关。下列说法中正确的是
A.焰色反应均应透过蓝色钴玻璃观察
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应是化学变化
D.焰色反应后金属丝用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
难度: 中等查看答案及解析
-
除去下列括号内的杂质,所加试剂和操作均正确的是
选项
需除杂的物质
试剂
操作
A
Fe2O3(Al2O3)
Na OH溶液
过滤
B
CO2(HCl)
Na OH溶液
将气体通过洗气瓶
C
NaCl(Na2CO3)
稀硫酸
蒸发结晶
D
Mg(Al)
氨水
过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组物质反应时,改变反应条件或者反应物的物质的量之比,生成的产物不变的是( )
A.Na与氧气
B.澄清石灰水与二氧化碳
C.Al与稀盐酸
D.氯化铝溶液与氢氧化钠溶液
难度: 中等查看答案及解析
-
下列说法中正确的是( )
①钠在空气中燃烧生成白色的氧化钠 ②钠投入硫酸铜溶液中有红色粉末产生 ③过氧化钠可在呼吸面具中做供氧剂 ④铁丝在氯气中燃烧生成棕黄色的FeCl3 ⑤钠、氢气在氯气中燃烧都能产生白烟
A.①② B.②③ C.③④ D.④⑤
难度: 中等查看答案及解析
-
化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
难度: 简单查看答案及解析
-
下列关于铁矿石的说法正确的是
A.赤铁矿的主要成分是Fe3O4
B.铁矿石的主要成分与铁锈的主要成分相同
C.磁铁矿粉末溶于盐酸后,加入KSCN溶液,溶液变红色
D.Fe3O4俗称铁红
难度: 中等查看答案及解析
-
高铁酸钠 (Na2FeO4)是一种高效的饮用水处理剂,可由下列方法制得:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O 关于该反应,下列说法正确的是
A.Fe(OH)3 中铁元素化合价为+3,只有氧化性
B.反应中 NaClO 是氧化剂,NaCl 是氧化产物
C.反应中每生成1 mol Na2FeO4,转移6 mol电子
D.Na2FeO4 具有强氧化性,能消毒杀菌
难度: 中等查看答案及解析
-
向一定量Fe、FeO、Fe2O3的混合物中,加入50mL1mol·L-1硫酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为
A. 11.2g B. 2.8g C. 5.62g D. 无法计算
难度: 中等查看答案及解析