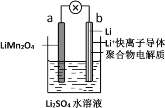
-
下列化合物中属于弱电解质的是
A.Na2SO4 B.HCl
C.Ba(OH)2 D.H2O
难度: 简单查看答案及解析
-
某反应的反应过程中能量变化如图1 所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是
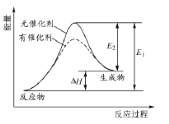
A. 该反应为放热反应
B. 催化剂能改变该反应的焓变
C. 催化剂能降低该反应的活化能
D. 逆反应的活化能大于正反应的活化能
难度: 中等查看答案及解析
-
在一定体积的密闭容器中,发生可逆反应2SO2(g)+O2(g)
2SO3(g),下列情况能说明该反应已经达到平衡的是
A.混合气体的质量不再变化
B.SO2与O2的速率之比为2︰1
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
难度: 简单查看答案及解析
-
下列关于多电子原子核外电子排布的说法错误的是
A.各能层含有的能级数等于能层序数
B.各能层的能级都是从s能级开始至f能级结束
C.各能层最多可容纳的电子数一定是偶数
D.各能级的原子轨道数按s、p、d、f的顺序依次为1、3、5、7
难度: 简单查看答案及解析
-
下列说法错误的是
A.同一原子中,1s、2s、3s电子的能量相同
B.1s22s12p1是激发态原子的电子排布式
C.基态溴原子的简化电子排布式是[Ar]3d104s24p5
D.某原子外围电子排布式是6s26p2,则该元素位于元素周期表的p区
难度: 中等查看答案及解析
-
下列事实能说明某一元酸HA是强电解质的是
A.常温下NaA溶液的pH=7
B.HA溶液能使紫色石蕊试液变红
C.用HA溶液和NaCl溶液做导电性实验,灯泡亮度相同
D.等体积、等物质的量浓度的HA与NaOH溶液两者恰好完全反应
难度: 中等查看答案及解析
-
在密闭容器中进行的下列反应:M(g)+N(g)
R(g)+2L,此反应符合下图。下列叙述正确的是
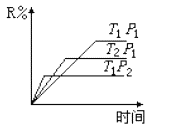
A.正反应吸热,L是气体
B.正反应吸热,L是固体
C.正反应放热,L是气体
D.正反应放热,L是固体或液体
难度: 中等查看答案及解析
-
常温、常压下,4.8 g碳(石墨)在一定量的氧气中燃烧,反应完成后碳无剩余,共放出100 kJ的热量。(已知:碳的燃烧热∆H=-394 kJ/mol ;2C(石墨)+O2(g)═2CO(g)∆H=-221 kJ/mol),则燃烧后的产物是
A.CO2 B.CO
C.CO2和CO D.无法确定
难度: 中等查看答案及解析
-
下列说法正确的是
A.酸式盐溶液一定显酸性
B.氯化铝溶液加热蒸干后得到氯化铝固体
C.醋酸溶液浓度稀释10倍,溶液中H+浓度减少到原来的十分之一
D.体积相同、pH相同的盐酸和醋酸溶液,与足量的锌反应产生氢气量不相同
难度: 中等查看答案及解析
-
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
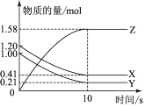
A. 反应开始到10 s,用Z表示反应速率为0.158 mol·L-1·s-1
B. 反应开始到10 s时,Y的转化率为79.0%
C. 反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
D. 反应的化学方程式为:X(g)+Y(g)
Z(g)
难度: 困难查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++OH-∆H>0,下列叙述正确的是
A.向水中加入稀氨水后,平衡逆向移动,c(OH-)降低
B.向水中加入少量硫酸氢钠固体后,c(H+)增大,Kw不变
C.由水电离出的c(H+)=1×10-12 mol/L的溶液pH一定为12
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
25℃时,在20 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,错误的是
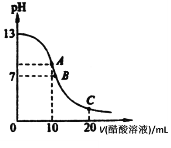
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C.在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
D.在A、B、C点:c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
难度: 中等查看答案及解析