-
在含有大量Ba2+、OH-、Cl-的溶液中,还可能大量共存的离子是
A. HCO3- B. NO3- C. H+ D. Fe3+
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是( )
A. SO2具有氧化性,可用于漂白纸浆
B. 明矾易溶于水,可用作净水剂
C. 浓硫酸具有脱水性,可用于干燥氢气
D. MgO、Al2O3熔点高,可用于制作耐火材料
难度: 简单查看答案及解析
-
化学与环境、材料、信息、能源关系密切。下列说法错误的是( )
A.计算机芯片的材料是二氧化硅
B.购物时用布袋代替塑料袋
C.减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量
D.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料
难度: 简单查看答案及解析
-
下列属于电解质的是( )
A.铝 B.酒精 C.食盐水 D.硫酸铜
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.质子数为17、中子数为20的氯原子:
Cl
B.硫离子的结构示意图:
C.亚硫酸的电离方程式:H2SO3=2H++2SO32-
D.明矾的化学式:KAlSO4·12H2O
难度: 简单查看答案及解析
-
现有三组混合液:①汽油和氯化钠溶液;②乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃);③氯化钠和单质溴的水溶液。分离以上各组混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.分液、蒸馏、萃取
C.萃取、蒸馏、分液 D.蒸馏、萃取、分液
难度: 简单查看答案及解析
-
下列各物质的分类、名称(俗名)、化学式都正确的是( )
A.碱性氧化物 氧化铁 FeO B.酸 硫酸 H2S
C.酸性氧化物 干冰 CO2(固态) D.盐 石膏 2CaSO4·H2O
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.钠钾合金通常状况下呈液态,可用于快中子反应堆的热交换剂
B.用丁达尔效应可以鉴别溶液和胶体
C.铁制容器可用于常温下贮存、运输浓硫酸
D.高炉炼铁的主要反应原理是碳在高温下直接将氧化铁还原成铁
难度: 中等查看答案及解析
-
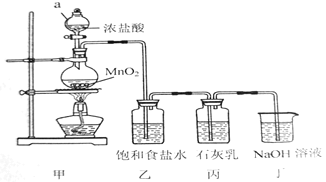
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的的是( )
A.
 制取SO2 B.
制取SO2 B. 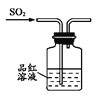 验证漂白性
验证漂白性C.
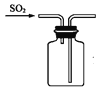 收集SO2 D.
收集SO2 D. 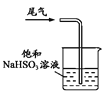 尾气处理
尾气处理难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3
K2O+5Na2O+16N2↑,有关该反应说法正确的是
A.属于复分解反应 B.KNO3发生氧化反应
C.NaN3是还原剂 D.NaN3和KNO3中氮元素化合价均降低
难度: 中等查看答案及解析
-
在氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列实验现象和结论一致且正确的是 ( )
A.加入有色布条,有色布条褪色,说明原溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明原溶液中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明原溶液中有HClO分子存在
难度: 简单查看答案及解析
-
在给定条作下,下列选项中所示的物质间转化能一步实现的是
A.Na
Na2O2
Na2CO3
B.MgCO3
MgCl2溶液
Mg
C.Al2O3
Al(OH)3
AlCl3
D.S
SO3
H2SO4
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.22.4L氢气中含有的氢分子数目为NA
B.标准状况下,4.48L水中含有的水分子数目为0.2NA
C.常温常压下,14g氮气含有的氮原子数目为NA
D.0.2mol·L-1CaCl2溶液中含有的氯离子数目为0.4NA
难度: 中等查看答案及解析
-
取7.90g KMnO4,加热分解后剩余固体7.42g。该剩余固体与足量的浓盐酸在加热条件下充分反应,生成单质气体A,产物中锰元素只以Mn2+存在。下列说法中错误的是( )
A.反应过程中生成氧气的物质的量是0.015mol
B.气体A是氯气,它的物质的量是0.095mol
C.KMnO4的分解率是60%
D.整个反应过程中转移了0.19mole-
难度: 中等查看答案及解析