-
化学来源于生活,服务于生活,下列说法不正确的是( )
A.高锰酸钾溶液能氧化乙烯,故浸有酸性高锰酸钾溶液的硅藻土可做水果保鲜剂
B.硅胶可作瓶装药品的干燥剂及催化剂载体,是因为SiO2是酸性氧化物
C.NaCl可作食品防腐剂
D.石墨烯是用石墨为原材料制成的蜂窝状平面薄膜,不属于烯烃
难度: 中等查看答案及解析
-
从草木灰中获取可溶性盐的实验过程中,下列操作未涉及的是( )
A.
B.
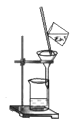 C.
C. 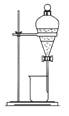 D.
D. 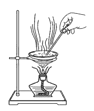
难度: 简单查看答案及解析
-
下列表示正确的是( )
A.二氧化硅晶体的分子式:SiO2 B.37Cl-的结构示意图:
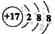
C.CCl4的比例模型:
D.氨基的电子式:
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.能使甲基橙变红的溶液中:Na+、NH4+、SO42-、NO3-
B.c(NO3-)=1mol/L的溶液中:H+、Fe2+、SO42-、Cl-
C.中性溶液中:NH4+、Fe3+、SO42-、Cl-
D.
=1×1012的溶液中:K+、Na+、S2O32-、F-
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.海洋中氯元素含量很大,因此氯元素被称为“海洋元素”
B.SO2有漂白性因而可使品红溶液、溴水褪色.
C.实验室从海带中提取单质碘的过程:取样→灼烧→溶解→过滤→萃取
D.将植物的秸秆加入沼气发酵池中生成沼气属于生物质能的生物化学转换
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.甲苯能使酸性高锰酸钾溶液褪色,说明甲基使苯环变活泼
B.在催化剂和高温下煤与氢气反应可以制得燃料油
C.通过红外光谱分析可以区分乙酸乙酯和硬脂酸甘油酯
D.棉花、鸡蛋白、ABS树脂都是由高分子化合物组成的物质
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2O分子间存在氢键,所以H2O比H2S稳定
B.He、CO2和CH4都是由分子构成,它们中都存在共价键
C.PCl5中各微粒最外层均达到8电子稳定结构
D.NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的-半,则下列说法正确的是( )
X
Y
Z
W
Q
A.离子半径:Q>W>Y
B.Y有多种同素异形体,而W不存在同素异形体
C.X与W可形成化合物XW2,该化合物可作溶剂
D.最高价氧化物的熔点:Z>X,因为氧元素与X、Z形成的共价键,后者键能更大
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-=3Fe3++NO↑+3H2O
B.向NaAlO2溶液中加入NaHCO3溶液:HCO3-+AlO2-+H2O=CO2↑+Al(OH)3↓
C.铁电极电解饱和食盐水:Fe+2H2O
Fe(OH)2↓+H2↑
D.向Ca(ClO)2溶液中通入过量的CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.可以用溴水除去己烷中的己烯
B.可以用氨水鉴别AlCl3溶液和AgNO3溶液
C.乙醇在浓硫酸催化下加热到170℃,将生成的气体先通过氢氧化钠溶液,再通入酸性KMnO4溶液中,溶液褪色,说明有乙烯生成。
D.苯酚钠溶液中滴加FeCl3溶液,先产生红褐色沉淀,随后变为紫色溶液
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.反应5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4LN2时转移的电子数为3.75NA
B.n(H2SO3)+n(HSO3-)=1mol的NaHSO3溶液中,含有Na+的数目等于NA
C.标准状况下甲烷和氧气的混合气体共22.4L,完全燃烧后产物的分子总数一定为NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
难度: 中等查看答案及解析
-
某课题组利用CO2催化氢化制甲烷,研究发现HCOOH是CO2转化为CH4的中间体,即:
,镍粉是反应I、II的催化剂。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
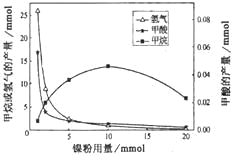
由图可知,当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是( )
A.反应I的速率增加,反应II的速率不变
B.反应I的速率不变,反应II的速率增加。
C.反应I、II的速率均增加,且反应I的速率增加得快
D.反应I、II的速率均增加,且反应II的速率增加得快
难度: 中等查看答案及解析
-
我国有机化学家发展了一些新型的有机试剂,如氟化试剂CpFluor-2,其与醇反应可以高产率、高选择性地生成氟代物。
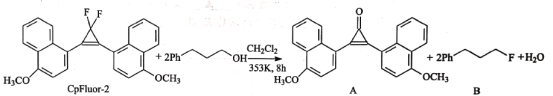
下列有关说法正确的是( )
A.该过程中只发生了取代反应 B.CpFluor-2苯环上的一氯代物有3种
C.CH2Cl2能跟氢氧化钠醇溶液发生消去反应 D.A中的官能团有醚键、羰基和碳碳双键
难度: 中等查看答案及解析
-
2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
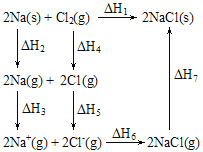
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
难度: 中等查看答案及解析
-
酸在溶剂中的电离是酸中的H+转移给溶剂分子,如:HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数Ka1(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.冰醋酸中H2SO4的电离方程式:H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B. H2SO4的冰醋酸溶液中:c(CH3COOH2+)= c(HSO4-)+ 2c(SO42-)+ c(CH3COO-)
C.浓度均为0.1mol/L的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸,
减小
难度: 困难查看答案及解析
-
利用膜技术原理和电化学原理制备少量硫酸和绿色硝化剂N2O5,装置如图所示,下列说法正确的是( )
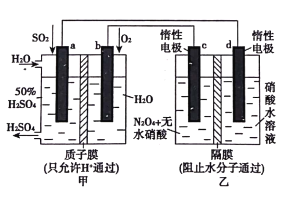
A.b电极反应式是O2+4e-+2H2O=4OH-
B.甲中每消耗l mol SO2,a电极附近溶液H+增加2mol
C.c电极反应式是N2O4-2e-+H2O=N2O5+2H+
D.甲、乙装置中分别生成的硫酸和N2O5的物质的量相等
难度: 中等查看答案及解析
-
常温下联氨(N2H4)的水溶液中有:
①N2H4+H2O
N2H5++OH- K1
②N2H5++H2O
N2H62++OH- K2
(提示:二元弱碱的电离也是分步电离)
该溶液中的微粒的物质的量分数δ(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是( )

A.据A点可求:K1=10-6
B.D点溶液的c(OH-)=10-l1
C.若C点为N2H5Cl溶液,则存在:c(Cl-)>c(N2H5+)+2c(N2H62+)
D.在N2H5Cl水溶液中,c(N2H4)+c(OH-)=2c(N2H62+)+c(H+)
难度: 中等查看答案及解析
-
已知还原性:I->Fe2+,某溶液中含如下离子组中的几种K+、Fe3+、Fe2+、Cl-、CO32-、NO2-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
②另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
③取②反应后溶液置于试管中加入CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.②中无色气体是NO气体,可能含有CO2气体
B.原溶液中Fe3+与Fe2+只存在一种离子
C.原溶液中NO2-与NO3-至少存在一种离子
D.为确定是否含有Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
难度: 中等查看答案及解析
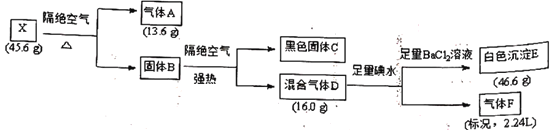

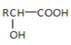
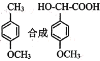 的路线。(用流程图表示,无机试剂任选)__________________
的路线。(用流程图表示,无机试剂任选)__________________