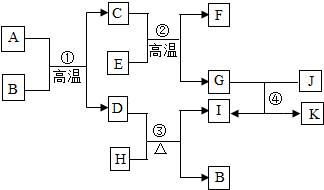
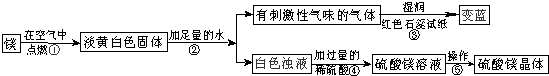
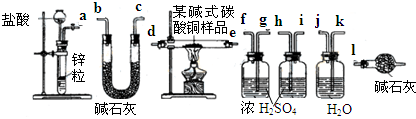
-
已知:NaHCO3+HCl═NaCl+H2O+CO2↑.某种混合气体中可能含有N2、HCl、CO,将混合气体依次通过NaHCO3溶液和灼热的CuO,气体体积无变化但是有红色物质生成;再通过NaOH溶液,气体体积明显减小;将燃着的木条伸入装有剩余气体的集气瓶中,木条熄灭(假设每步反应都是完全的),则下列说法中正确的是( )
A.一定有CO和HCl,肯定无N2
B.一定有CO和N2,可能有HCl
C.一定有CO和HCl,可能有N2
D.一定有CO和N2,肯定无HCl难度: 中等查看答案及解析
-
2009年4月22日是第40个世界地球日,今年世界地球日的主题是“绿色世纪”.下列行为不符合这一主题的是( )
A.分类回收、利用垃圾,减少资源浪费
B.推广使用一次性木筷,减少疾病传染
C.开发风能等新能源,减少使用化石燃料
D.使用催化净化装置,减少汽车尾气的污染难度: 中等查看答案及解析
-
你认为下列实验方案中,可行的是( )
A.按溶解、过滤、蒸发的操作顺序可以分离CaCl2、CaCO3的混合物
B.向某种未知溶液中加入AgNO3溶液,产生白色沉淀,证明溶液是盐酸
C.用磷在密闭容器中燃烧,除去密闭容器内空气中的氧气
D.将pH试纸润湿后,用玻璃棒蘸取食用白醋滴在试纸上,测定其pH难度: 中等查看答案及解析
-
印刷铜制电路板的“腐蚀液”为FeCl3溶液.已知铁、铜均能与FeCl3溶液反应,反应方程式分别为:Fe+2FeCl3=3FeCl2,Cu+2FeCl3=2FeCl2+CuCl2.向盛有FeCl3溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现( )
A.烧杯中有铜粉无铁粉
B.烧杯中有铁粉无铜粉
C.烧杯中有铁粉有铜粉
D.烧杯中无铁粉无铜粉难度: 中等查看答案及解析
-
已知硫酸溶液的密度随质量分数增大而增大,若将溶质质量分数分别为10%和30%的两种硫酸溶液等体积混合,则混合后所得溶液溶质的质量分数为( )
A.大于20%
B.等于20%
C.小于20%
D.以上都有可能难度: 中等查看答案及解析
-
以下四种实验操作对应的曲线正确的是( )
A.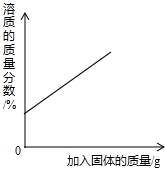
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.
向硫酸铜溶液中加入过量的氢氧化钠溶液
C.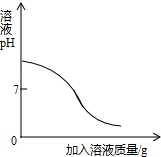
向稀盐酸中滴加过量的氢氧化钠溶液
D.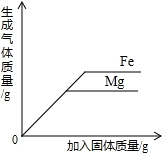
向等质量的金属镁和铁中分别加入足量且质量分数相等的稀盐酸难度: 中等查看答案及解析
-
有一类化学反应,反应前后某些元素化合价会发生变化,这类反应我们称之为氧化还原反应.如
↑+2H2OMn元素从反应前的+4价变为反应后的+2价,Cl元素从反应前的-1价变为反应后的0价,这一反应就是氧化还原反应.下列类型的反应,一定是氧化还原反应的( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应难度: 中等查看答案及解析
-
下列各组溶液中,不另加任何试剂就能将它们区别开来的是( )
A.Na2CO3、Ba(OH)2、Na2SO4、HNO3
B.NaOH、FeCl3、H2SO4、NaCl
C.BaCl2、Na2SO4、CaCl2、Ca(NO3)2
D.BaCl2、KHCO3、NaCl、Na2SO4难度: 中等查看答案及解析
-
如图是M、N两种物质的溶解度曲线,在t2℃时往盛有100g水的烧杯中先后加入agM和agN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌,将混合物的温度降低到t1℃,下列说法正确的是( )
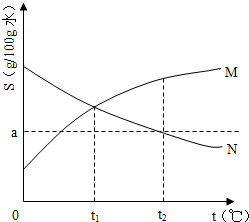
A.t1℃时,M、N的溶解度相等,得到M、N的饱和溶液
B.t2℃时,得到M的饱和溶液、N的不饱和溶液
C.t1℃时,M、N的溶质质量分数一定相等
D.t2℃时,M、N的溶质质量分数一定相等难度: 中等查看答案及解析
-
某同学取不同质量的某铁和铝的合金分别与等质量的盐酸反应,测得如下数据(盐酸的质量分数相等).则下列分析推理中不正确的是( )
100g盐酸 100g盐酸 100g盐酸 所取合金质量 13.9g 16.9g 19.9g 产生H2质量 0.7g 0.8g 0.8g
A.盐酸的质量分数为29.2%
B.根据表中数据不能计算出合金中铁的质量分数
C.加入合金13.9g时盐酸过量
D.加入合金16.9g时恰好与盐酸完全反应难度: 中等查看答案及解析