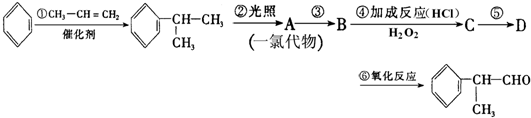
-
前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老.因此卫生部已开始加紧调查巨能钙.下列有关说法错误的是( )
A.H2O2、Na2O2都属于过氧化物,都存在共价键
B.双氧水是绿色氧化剂,可作医疗消毒剂
C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性
D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、SO2不同难度: 中等查看答案及解析
-
某FeSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol•L-1,则此溶液最多可溶解铁粉的质量为( )
A.11.2g
B.16.8g
C.19.6g
D.22.4g难度: 中等查看答案及解析
-
下列说法正确的是( )
A.常温常压下,只有一种元素的单质呈液态
B.周期表中所有元素都有从自然界中发现的
C.过渡元素不全是金属元素
D.常温常压下,气态单质的分子都是由非金属元素的原子形成的难度: 中等查看答案及解析
-
下列化学反应的离子方程式正确的是( )
A.将铝片加入烧碱溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑
B.将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑
C.向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O
D.向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.3.4gNH3中含N-H键数目为0.2NA
B.27gAl在标准状况下的22.4LCl2中燃烧,转移的电子总数为3NA
C.0.5mol•L-1CuCl2溶液中含Cl-数为NA
D.84gNaHCO3与MgCO3的混合物中所含氧原子数目为3NA难度: 中等查看答案及解析
-
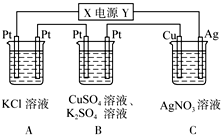
加碘食盐中含有碘酸钾(KIO3),现以电解法制备碘酸钾,实验装置如图所示.先将一定量的碘溶于过量氢氧化钾溶液,发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区,另将氢氧化钾溶液加入阴极区,开始电解.下列说法正确的是( )
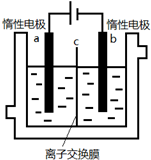
A.a电极是阴极
B.a极区的KI最终转变为KIO3
C.阳极电极反应:4OH--4e-═2H2O+O2↑
D.电解过程中OH-从a极区通过离子交换膜c进入b极区难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A.原子最外层电子数为2的元素一定是金属元素
B.HF、HCl、HBr、HI的热稳定性和还原性都依次增强
C.同主族元素形成的氧化物晶体类型相同
D.化合物XY3中,X可能呈-3价,Y可能呈+1价难度: 中等查看答案及解析
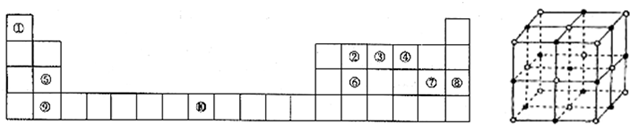
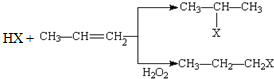 (X为卤素原子)
(X为卤素原子)