-
下列说法正确的是
A.上图所示的是一个放热反应 B.加入催化剂v(正)增大、v(逆)减小
C.燃烧热是生成1molH2O放出的热量 D.只有活化分子才能发生有效碰撞
难度: 中等查看答案及解析
-
对于反应A(g)+3B(g)
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.2mol/(L•s) B.v(B)=0.2 mol/(L•s)
C.v(B)=0.3mol/(L•s) D.v(C)=0.2mol/(L•s)
难度: 中等查看答案及解析
-
一定量的稀盐酸跟过量锌粉反应时,为了减缓反应速率又不影响生成H2的总量,可采取的措施是
A.加入少量稀NaOH溶液 B.加入少量CH3COONa固体
C.加入少量NH4HSO4固体 D.加入少量Na2CO3浓溶液
难度: 中等查看答案及解析
-
下图为一原电池的结构示意图,下列说法中,错误的是
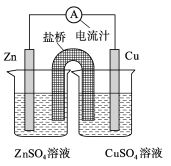
A.Cu电极为正电极
B.原电池工作时,电子从Zn电极流出
C.原电池工作时的总反应为:Zn+Cu2+=Zn2++Cu
D.盐桥(琼脂-饱和KCl溶液)中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
下列表述中,合理的是
A.将水加热,Kw增大,pH不变
B.把FeCl3的水溶液加热蒸干可得到FeCl3固体
C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液
D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银
难度: 中等查看答案及解析
-
某小组为研究电化学原理,设计如图装置。下列叙述错误的是
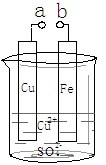
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色
难度: 中等查看答案及解析
-
若醋酸用HAc表示,则在0.1mol·L-1 NaAc溶液中,下列离子浓度关系正确的是
A.c(Na+)= c(Ac—)+c(HAc)
B.c(Na+)+c(OH—)= c(Ac— )+c(H+)
C.c(Na+)>c(OH—) > c(Ac—) > c(H+)
D.c(Na+)> c(Ac—)> c(H+)> c(OH—)
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应: A(s)+2B(g)
C(g)+D(g)已达到平衡状态的现象是
A.混合气体的压强 B.混合气体的密度
C.气体的总物质的量 D.单位时间内生成n mol C的同时消耗2n molB
难度: 中等查看答案及解析
-
下列有关表述正确的是
A.加入催化剂不会使化学平衡移动
B.把封有NO2的烧瓶浸入热水中,颜色变浅
C.用30%的FeCl3溶液腐蚀印刷线路板上的铜箔:Fe3+ + Cu=Fe2+ + Cu2+
D.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
利用电解法可将含有Fe、Zn、Ag、Pt等杂质的粗铜提纯,下列叙述正确的是
A. 电解时以精铜作阳极
B.电解时阴极发生还原反应
C.粗铜连接电源负极,其电极反应是Cu =Cu2+ + 2e-
D.电解结束,电解槽底部会形成含少量Ag、Pt等金属的阳极泥
难度: 中等查看答案及解析
-
一定条件下,在容积为10L的密闭容器中,将l mol X和1 mol Y进行如下反应:
2X(g)+Y(g)
Z(g),经60 s达到平衡生成0.3 mol的Z,下列说法正确的是( )
A.60 s内X的平均反应速率为0.001 mol·L-1·s-1
B.将容器的容积变为20 L,Z的新平衡浓度将等于原平衡浓度的1/2
C.若温度和体积不变,往容器内增加1 mol X,Y的转化率将增大
D.若升高温度,X的体积分数增大,则正反应的△H>0
难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)
2C(g) △H<0,下列各图正确的是( )
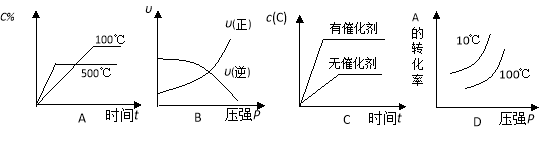
难度: 中等查看答案及解析
