-
下列说法中正确的是
A.俄国化学家门捷列夫采用相对原子质量的大小排列元素在周期表的位置
B.设NA代表阿伏加德罗常数,则22.4 L氯气中一定含有2 NA个氯原子
C.除去氢气中混有的少量氧气,使气体通过灼热的铜网
D.pm 2. 5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.已知电离平衡常数:H2CO3>HClO>HCO3-,向NaClO溶液中通入少量二氧化碳:
2ClO-+CO2+ H2O =2HClO+CO32-
C.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
D.等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:
Ba2+ + 2OH- + NH4+ + HCO3- = BaCO3↓ + NH3•H2O + H2O
难度: 中等查看答案及解析
-
下列实验不能达到目的的是
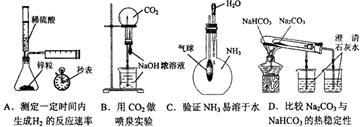
难度: 中等查看答案及解析
-
将0.2 mol/L HCN溶液和0.1 mol/L的NaOH溶液等体积混合后,溶液显碱性,下列关系式中不正确的是
A.c(HCN)-c(CN-)=2c(OH-) - 2c(H+)
B. c(Na+)<c(CN-)
C.c(HCN)-c(Na+)=c(OH-) - c(H+)
D. c(HCN)+c(CN-)=0.1 mol/L
难度: 中等查看答案及解析
-
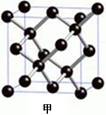
W、X、Y、Z是元素周期表中前四周期元素,它们在周期表中的相对位置如图所示。
下列有关叙述中正确的是
A.Z元素一定是金属元素
B.X、Y、W一定是主族元素
C.若W的单质在空气中燃烧有三种固体产物,则Y的单质既能与强酸溶液反应又能与强碱溶液反应
D.Z既可能在三周期,也可能在四周期
难度: 中等查看答案及解析
-
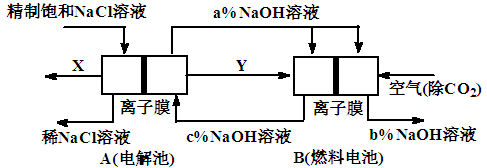
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如下所示。下列说法中正确的是
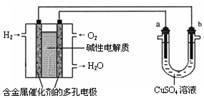
A.燃料电池工作时,负极反应为:H2 – 2e-= 2H+
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下当电池中消耗H2 22.4 L(标准状况)时,a极析出铜64 g
难度: 中等查看答案及解析
-
某物质的结构简式如图,关于该物质的下列说法中正确的是
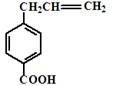
A.它的部分同分异构体能发生水解反应时则不能发生消去反应
B.分子中所有的碳原子不可能处于同一平面上
C.该化合物的化学式为C10H11O2
D.该化合物能与新制的Cu(OH)2溶液发生反应生成砖红色沉淀且苯环上的一氯代物只有一种的同分异构体有4种
难度: 中等查看答案及解析