-
化学与生产、生活密切相关。下列叙述正确的是
A.煤的干馏和煤的液化均是物理变化
B.用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
C.天然纤维和合成纤维的主要成分都是纤维素
D.海水淡化的方法有蒸馏法、电渗析法等
难度: 简单查看答案及解析
-
下列解释事实的化学方程式不正确的是
A.金属钠在空气中加热,生成淡黄色固体:2Na+O2 △ Na2O2
B.向硫酸铝溶液中加入氨水制备氢氧化铝:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
C.铁在潮湿的环境中生锈:3Fe+4H2O= Fe3O4+4H2↑
D.二氧化氮溶于水有硝酸生成:3NO2+H2O=2HNO3+NO
难度: 中等查看答案及解析
-
下列关于反应能量的说法正确的是
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s)ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.已知2H2(g)+O2(g)= 2H2O(g)ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的NaOH溶液与含
0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如下图。下列说法不正确的是
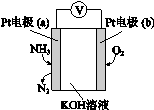
A.O2在电极b上发生还原反应
B.溶液中OH—向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析
-
依据下列实验现象,得出的结论正确的是
选项
操作
实验现象
结论
A
向NaBr溶液中加入氯水,再加入淀粉KI溶液
溶液变蓝
氧化性:Cl2>Br2>I2
B
将铝片放入盐酸中
产生气泡的速率先慢后快,再逐渐减慢
H+的浓度是影响反应速率的唯一因素
C
向蔗糖溶液中加入稀硫酸,水浴加热后,加入新制氢氧化铜加热
得到蓝色溶液
蔗糖水解产物没有还原性
D
向漂白粉中滴入稀硫酸,将生成的气体通入品红溶液
品红溶液褪色
气体中含有Cl2
难度: 中等查看答案及解析
-
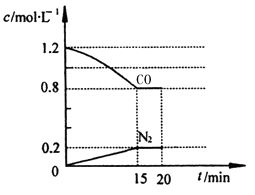
恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:
MgSO4(s)+CO(g)
MgO(s)+CO2(g)+SO2(g)
反应过程中测定的部分数据见下表:
反应时间/min
n(MgSO4)/mol
n(CO)/mol
n(SO2) / mol
0
2.0
2.0
0
2
0.8
4
1.2
6
1.2
2.8
下列说法正确的是
A.0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B.4 min后,平衡移动的原因可能是向容器中加入了2.0 mol的SO2
C.4 min后,若升高温度,SO2物质的量浓度变为0.7mol/L,则正反应为放热反应
D.其他条件不变,若起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
难度: 困难查看答案及解析
-
卤素互化物与卤素单质性质相似。已知CH2=CH-CH=CH2(1,3-丁二烯)与氯气发生1∶1加成产物有两种:
①CH2Cl-CHCl-CH=CH2 (1,2-加成)②CH2Cl-CH=CH-CH2Cl (1,4-加成)
据此推测CH2=C(CH3)-CH=CH2(异戊二烯)与卤素互化物BrCl的1∶1加成产物有几种(不考虑顺反异构和镜像异构)
A.6种 B.7种 C.8种 D.9种
难度: 困难查看答案及解析