-
下列我国古代技术应用中,其工作原理不涉及化学反应的是( )
A.黑火药爆炸 B.用铁矿石炼铁 C.湿法炼铜 D.转轮排字
难度: 简单查看答案及解析
-
必须随配随用,不能长期存放的试剂是( )
A. 氢硫酸 B. 盐酸 C. AgNO3溶液 D. NaOH溶液
难度: 简单查看答案及解析
-
能用元素周期律解释的是( )
A. 酸性:H2SO3>H2CO3 B. 熔沸点:HF>HCl
C. 碱性:NaOH>Al(OH)3 D. 热稳定性:Na2CO3>CaCO3
难度: 简单查看答案及解析
-
用氯气和绿矾处理水,下列说法错误的是( )
A.氯气起杀菌消毒作用
B.氯气氧化绿矾
C.绿矾具有净水作用
D.绿矾的氧化产物具有净水作用
难度: 简单查看答案及解析
-
下列关于自然界中氮循环示意图(如图)的说法错误的是( )
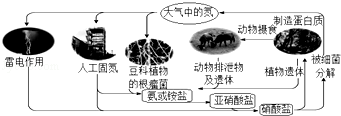
A.氮元素只被氧化
B.豆科植物根瘤菌固氮属于自然固氮
C.其它元素也参与了氮循环
D.含氮无机物和含氮有机物可相互转化
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )

A. 原子半径由大到小的顺序:X、Y、Z、W
B. 元素最高正价由低到高的顺序:X、Y、Z、W
C. 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D. 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
难度: 简单查看答案及解析
-
证明溴乙烷与NaOH醇溶液共热发生的是消去反应,分别设计甲、乙、丙三个实验:(甲)向反应混合液中滴入溴水,溶液颜色很快褪去.(乙)向反应混合液中滴入过量稀硝酸,再滴入AgNO3溶液,有浅黄色沉淀生成.(丙)向反应混合液中滴入酸性KMnO4溶液,溶液颜色褪去.则上述实验可以达到目的是( )
A.甲 B.乙 C.丙 D.都不行
难度: 中等查看答案及解析
-
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确
的是( )
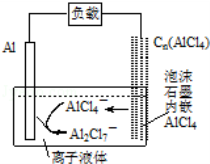
A.放电时,负极发生:2AlCl4﹣﹣e﹣=Al2Cl7﹣+Cl﹣
B.放电时,电路中每流过3mol电子,正极减少27g
C.充电时,泡沫石墨极与外电源的负极相连
D.充电时,阴极
发生:4Al2Cl7﹣+3e﹣=Al+7A
lCl4﹣
难度: 简单查看答案及解析
-
分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( )
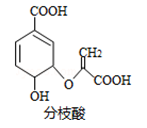
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 简单查看答案及解析
-
H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
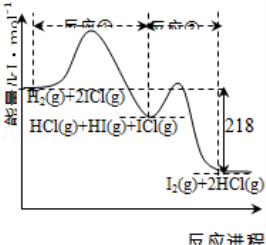
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为△H=﹣218kJ•mol﹣1
难度: 简单查看答案及解析
-
如图中U→Z六
种物质在适当条件下能实现图示箭头方向一步转化,且反应①、②均为置换反应,满足条件的物质组是( )

序号
U
W
Y
X
①
Na
H2O
Na2O2
NaOH
②
Fe
H2O
C
H2
③
HBr
Cl2
CH4
HCl
④
CuCl2(aq)
Al
HCl(aq)
AlCl3(aq)
A.②④ B.②③ C.①②④ D.①②③④
难度: 中等查看答案及解析
-
如图是N2(g)+3H2(g)
2NH3(g)在反应过程中的反应速率v与时间(t)的关系
曲线,下列说法错误的是( )

A.t1时,正方向速率大于逆反应速率
B.t2时,反应体系中NH3的浓度达到最大值
C.t2﹣t3时间段,正反应速率等于
逆反应速率
D.t2﹣t3时间段,各物质的浓度相等且不再发生变化
难度: 简单查看答案及解析
-
某稀硫酸和稀硝酸混合溶液100mL,逐渐加入铁粉,产生气体的量随铁粉加入量的变化如图所示.下列说法错误的是( )
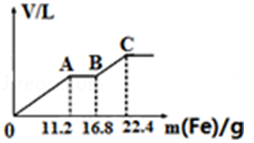
A.H2SO4浓度为4mol/L
B.溶液中最终溶质为FeSO4
C.原混合酸中NO3﹣浓度为0.2mol/L
D.AB段反应为:Fe+2Fe
3+→3Fe2+
难度: 中等查看答案及解析
-
已知酸性溶液中还原性的顺序为SO32﹣>I﹣>Fe2+>Br﹣>Cl﹣,下列反应不能发生的是( )
A.2
Fe3++SO32﹣+H2O→2Fe2++SO42﹣+2H+
B.I2+SO32﹣+H2O→SO42﹣+2I﹣+2H+
C.2Fe2++I2→2Fe3++2I﹣
D.Br2+SO32﹣+H2O→SO42﹣+2Br﹣+2H+
难度: 中等查看答案及解析
-
用如图装置进行实验,甲逐滴加入到固体乙中,如表说法正确的是( )

选项
液体甲
固体乙
溶液丙
丙中现象
A
CH3COOH
NaHCO3
苯酚钠
无明显现象
B
浓HCl
KMnO4
紫色石蕊
最终呈红色
C
浓H2SO4
Na2SO3
品红
红色变无色
D
浓H2SO4
Cu
氢硫酸
溶液变浑浊
A.A B.B C.C
D.D
难度: 中等查看答案及解析
-
不能判断甲比乙非金属性强的事实是( )
A. 常温下甲能与氢气直接化合,乙不能
B. 甲的氧化物对应的水化物酸性比乙强
C. 甲得到电子能力比乙强
D. 甲、乙形成的化合物中,甲显负价,乙显正价
难度: 简单查看答案及解析
-
有3份等量的烧碱溶液,第1份直接与盐酸反应;第2份稀释一倍,再与盐酸反应;第3份通入适量的CO2后,再与盐酸反应.若盐酸的浓度相同,完全反应时消耗盐酸的体积分别为V1、V2和V3,则V1、V2和V3的大小关系正确的是( )
A.V1=V2=V3 B.V1>V3>V2 C.V2>V3>V1 D.V1>V2>V3
难度: 中等查看答案及解析
-
如图是CO2生产甲醇的能量变化示意图.下列说法正确的是( )

A.E2_E1是该反应的热效应
B.E3_E1是该反应的热效应
C.该反应放热,在常温常压下就能进行
D.实现变废为宝,且有效控制温室效应
难度: 简单查看答案及解析
-
常温下,用0.05mol•L﹣1 KOH溶液滴定 10.00mL0.05mol•L﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法正确的是( )
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+2c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 mol•L﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
难度: 简单查看答案及解析
-
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )

A.x>y B.SO2是该反应的催化剂
C.MFe2Ox是还原剂 D.氧化性:MFe2Oy>SO2
难度: 中等查看答案及解析
-
如图是用稀HNO3和Cu制取少量NO并验证氮氧化合物性质的装置.下列说法错误的是( )

A.吸收剂可以是NaOH溶液 B.试管上部的气
体会变为红棕色
C.小试管中溶液最终呈蓝色 D.试纸先变红后褪色
难度: 中等查看答案及解析
-
将NaHCO3
和Na2O2的固体混合物x g在密闭容器中加热至250℃,充分反应后排出气体.将反应后的固体溶入水无气体放出,再逐滴加入盐酸,产生气体(标准状况)与所加盐酸体积之间的关系如图所示.下列说法错误的是( )
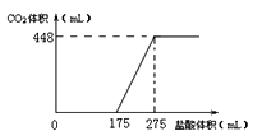
A.HCl的浓度0.2mol/L
B.反应后固体的成分为NaO
H与Na2CO3
C.密闭容器中排出气体的成分为O2和H2O
D.x的数值为6.09
难度: 困难查看答案及解析
-
下列说法正确的是( )
A.常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(Na+)>c(B﹣)>c(H+)>c(OH﹣)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4 中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB﹣)>c(H2B)>c(B2﹣)
难度: 简单查看答案及解析
-
关于下列各图的叙述,正确的是( )
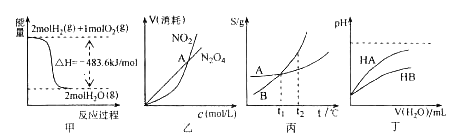
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj•mol﹣1
B.乙表示恒温恒容条件下发生的可逆反应2NO2
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
难度: 困难查看答案及解析
-
取100mL 18.3mol•L﹣1 的H2SO4与Zn反应,当Zn完全溶解时,生成的气体(可使品红褪色)在标准状况下的体积为22.4L.将所得的溶液稀释成1L,测得溶液H+的浓度为1mol•L﹣1,则所生成的气体中SO2与H2的体积比约为( )
A.1:2 B.2:1 C.1:4 D.4:1
难度: 简单查看答案及解析
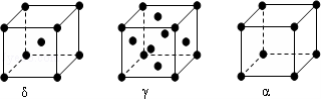

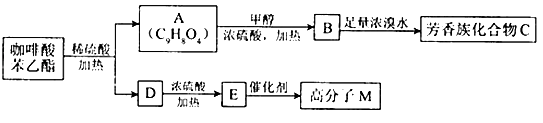
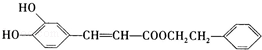 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化: