-
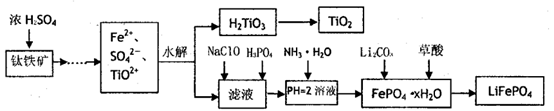
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下图所示。
FeCl3·6H2O
FeOOH
纳米四氧化三铁
下列有关叙述不合理的是
A.纳米四氧化三铁可分散在水中,它与FeCCl3溶液的分散质直径相当
B.纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C.在反应①中环丙胺的作用可能是促进氯化铁水解
D.反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O十CO2
难度: 中等查看答案及解析
-
常温下,下列各组微粒在指定溶液中一定能大最共存的是
A.由水电离的c(H+)=1×l0-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
B.pH=1的溶液中:K+、Cr2O72-、SO42-、CH3CHO
C.加石蕊呈蓝色的溶液中:Na+、K+、AlO2-、NO3-
D.通入足量CO2后的溶液中:NH4+、Na+、C6H5O-、Cl-
难度: 中等查看答案及解析
-
最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是
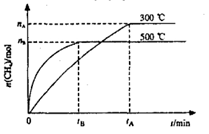
A.101KPa、120℃时,该反应的平衡常数表达式
B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率
D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变
难度: 中等查看答案及解析
-
仅用下表提供的仪器和药品,就能达到相应实验目的是
编号 仪器 药品 实验目的
A 托盘天平(带砝码)、胶头滴管、量筒、烧杯、约匙、玻璃棒 NaCl固体、蒸馏水 配制一定质量分数的NaCl溶液
B 分液漏斗、烧瓶、锥形瓶、 导管及橡皮塞 盐酸、大理石、碳酸钠溶液 证明非金属性:Cl>C>Si
C 酸式滴定管、胶头滴管、铁架台(带铁夹) 已知浓度的盐酸、待测NaOH溶液 测定NaOH溶液的物质的量浓度
D 烧杯、分液漏斗、胶头滴管、铁架台 待提纯的A1C13溶液、NaOH溶液 提纯混有MgC12杂质的AlCl3溶液
难度: 中等查看答案及解析
-
科学家们在研制一种吸气式的锂一空气电池,工作时吸收空气中的氧气在多孔金制成正极表面上反应。总反应可表示为2Li+O2
Li2O2,下列有关说法正确的是
A.充电时,多孔金制成的电极外接电源负极
B.放电时,吸收空气中22.4L的O2,就有2mole-从电池负极流出
C.放电时,Li+从负极向正极移动
D.该电池可使用含Li+的水溶液作电解质溶液
难度: 中等查看答案及解析
-
已知25℃时:
① NH4+ (aq)+OH-(aq)=NH3·H2O(aq) ΔH=a kJ·mol-1
② NH4+ (aq)+H2O(1)
NH3·H2O(aq)十H+(aq) ΔH=bkJ·mol-1向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,下列有关说法正确的是
A.水电离过程的热化学方程式可表示为:H2O(1)
H+(aq)+OH-(aq) ΔH=(a-b)KJ/mol
B.当滴入10mL盐酸时,溶液中:c(NH4+)+c(NH3·H2O)=2c(Cl-)
C.随着盐酸的逐滴加入,水电离的c(OH-)总是逐渐减小
D.当滴入20 mL盐酸时,溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
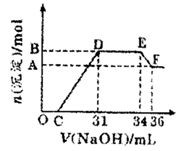
分析上述图形,下列说法不正确的是
A.OC段离子反应方程式:H+十OH-=H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(NH4+)=0.012mol
D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量
难度: 中等查看答案及解析
-
X、Y、Z、W是元素周期表中前四周期原予序数依次增火的四种元素,其相关信息如下表:
元素
相关信息
X
X的基态原子核外只有三个能级,且各能级电子数相等
Y
Y的基态原子最外层电子数是其内层电子总数的3倍
Z
Z的基态原子价电于排布为nsn-1
W
W的单质是一种常见的红色金属,在潮湿的空气中易生成绿色的锈斑
(1)W位于元素周期表第________周期第________族,其基态原子核外有________个未成对电子。
(2)与Z同周期且依次相邻的两种元素的原子与Z比较,三者第一电离能的大小顺序为________
[用元素符号表示];Y的氢化物在同族的氢化物中沸点反常,其原因是________。
(3)写出W的单质在潮湿的空气中生成绿色锈斑的化学方程式,并标出电子转移的方向和数目________。
(4)往X、Y与氢三种元素组成的多种分子中,有些分子的核磁共振氢谱显示有三种氢,且数目比为1:2:3,写出其中一种分子的名称________。X、Y可以形成多种弱酸根离子,写出其中一种离子水解的的离子方程式________
难度: 中等查看答案及解析
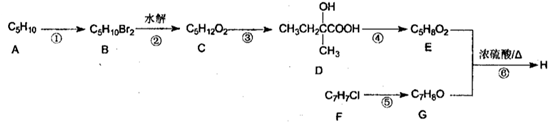
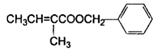 )是一种重要的香精素,有关合成路线如下:
)是一种重要的香精素,有关合成路线如下: