-
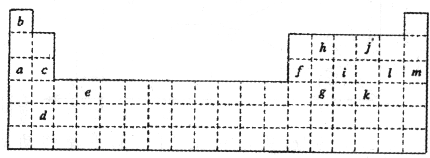
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强难度: 中等查看答案及解析
-
向三份1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大难度: 中等查看答案及解析
-
下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数)难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.铁表面镀锌,铁作阳极
B.船底镶嵌锌块,锌作负极,以防船体被腐蚀
C.钢铁吸氧腐蚀的正极反应:O2+2H2O+4e-=4OH-
D.工业上电解饱和食盐水的阳极反应:2Cl--2e-=Cl2难度: 中等查看答案及解析
-
用0.10mol•L-1的盐酸滴定0.10mol•L-1的氨水,滴定过程中不可能出现的结果是( )
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
C.c(Cl-)>c(NH4+),c(OH-)>c(H+)
D.c(Cl-)>c(NH4+),c(H+)>c(OH-)难度: 中等查看答案及解析
-
《中华人民共和国食品安全法》于2009年月1日起实施.下列做法不利于安全的是( )
A.用聚氯乙烯塑料袋包装食品
B.在食品盐中添加适量的碘酸钾
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量难度: 中等查看答案及解析
-
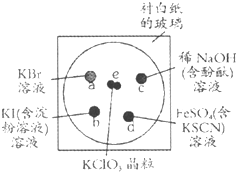
在一无色未知溶液中检验出有Ba2+、Ag+同时又测得其酸性很强.某学生还要鉴定此溶液中是否大量存在:①Cu2+ ②Fe3+ ③Cl- ④
⑤S2-⑥
⑦
⑧Mg2+⑨Al3+ ⑩
离子.其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是( )
A.③⑤⑥⑦⑩
B.①②⑤⑥⑧⑨
C.③④⑦⑧⑨
D.①②③⑤⑥⑩难度: 中等查看答案及解析
-
广州将于2010年承办第16届亚运会.下列措施有利于节能减排、改善环境质量的有( )
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾.
A.①②③④
B.①②⑤
C.①②④⑤
D.③④⑤难度: 中等查看答案及解析
-
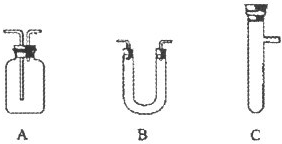
具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是( )
A.
B.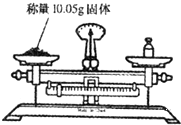
C.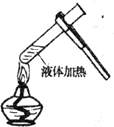
D.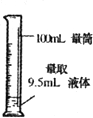
难度: 中等查看答案及解析
-
用右图表示的一些物质或概念之间的从属或包含关系中错误的是( )
X Y Z 例 氧化物 化合物 纯净物 A 溶液 分散系 混合物 B 铜 金属元素 元素 C 强电解质 电解质 化合物 D 置换反应 氧化还原反应 离子反应
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
如图是制取气体的一种装置,不能用此“随开随用,随关随停”装置制取气体的是( )
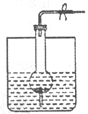
A.实验室用大理石和稀盐酸制取CO2
B.碱石灰与浓氨水制NH3
C.锌粒和稀硫酸制氢气
D.铝片与烧碱溶液制H2难度: 中等查看答案及解析
-
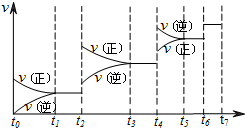
T℃时,N2与H2反应生成NH3,其能量变化如图(I)所示.若保持其他条件不变,温度分别为T1℃和T2℃时,H2的体积分数与时间的关系如图(Ⅱ)所示.则下列结论正确的是( )
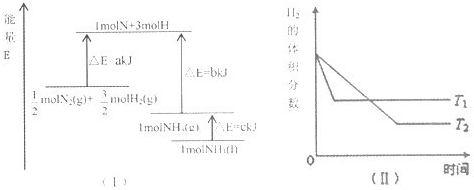
A.该反应的热化学方程式是:N2(g)+
⇌NH3(g)△H=-(a+b)kJ•mol-1
B.该反应的热化学方程式:N2(g)+3H2(g)⇌2NH3(l)△H=-2(b+c-a)kJ•mol-1
C.T1<T2,且正反应为放热反应
D.其他条件不变,升高温度,正、逆反应速率均增大,且H2的转化率增大难度: 中等查看答案及解析
-
下列所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
a b c A Al AlCl3 Al(OH)3 B HNO3 NO NO2 C Si SiO2 H2SiO3 D CH2=CH2 CH3CH2OH CH3CHO
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.将CO2通入BaCl2溶液中至饱和,无沉淀产生;再通入SO2,产生沉淀
B.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶
C.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失
D.纯锌与稀硫酸反应产生氢气的速率较慢;再加入少量CuSO4固体,速率不改变难度: 中等查看答案及解析
-
能实现下列物质间直接转化的元素是( )
单质氧化物
酸或碱
盐.
A.硅
B.硫
C.铜
D.铁难度: 中等查看答案及解析
-
下列文字表述与反应方程式对应且正确的是( )
A.溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓
B.用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑
C.利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+
D.实验室用液溴和苯在催化剂作用下制溴苯:难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)⇌Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]•[SO42-],称为溶度积常数)( )
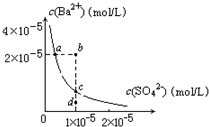
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp难度: 中等查看答案及解析
-
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.据图判断正确的是( )

A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点KW的数值比c点KW的数值大
D.b点酸的总浓度大于a点酸的总浓度难度: 中等查看答案及解析