-
已知:C(s)+CO2(g)⇌2CO(g)△H>0.该反应达到平衡后,下列条件有利于反应向正方向进行的是( )
A.降低温度和增大压强
B.降低温度和减小压强
C.升高温度和减小压强
D.升高温度和增大压强难度: 中等查看答案及解析
-
下列说法正确的是( )
A.钢铁发生电化腐蚀的正极反应式:Fe→Fe2++2e-
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-→4OH-
C.粗铜精炼时,与电源正极相连的是纯铜
D.用惰性电极电解饱和食盐水时,阳极的电极反应式2Cl--2e-→Cl2↑难度: 中等查看答案及解析
-
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是( )
A.加入一种反应物
B.升高温度
C.对平衡体系增加压强
D.使用催化剂难度: 中等查看答案及解析
-
在恒温下密闭容器内发生反应 P(g)+Q(g)⇌R(g)+S(g)已达到平衡的是( )
A.反应容器内的压强不随时间改变
B.反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C.P的生成速率和S的生成速率相等
D.反应容器内的气体总物质的量不随时间变化难度: 中等查看答案及解析
-
下列关于反应热的说法正确的是( )
A.当△H为负值时,表示该反应为吸热反应
B.反应热的大小与反应物所具有的能量和生成物具有的能量无关
C.反应热的大小只与反应体系的始态和终态有关
D.热化学方程式2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol表示2L氢气和1L氧气反应放出571.6 kJ的热量难度: 中等查看答案及解析
-
2006年巴黎车展示上,世界各大汽车商纷纷推出环保动力小汽车,使用的新型环保电池为( )
A.氢氧燃料电池
B.锌锰电池
C.镍镉电池
D.铅蓄电池难度: 中等查看答案及解析
-
已知A2(g)+2B2(g)⇌2AB2(g)△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.升高温度反应速率增加,从而缩短达到平衡的时间
C.升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度平衡常数K增大难度: 中等查看答案及解析
-
下列说法正确的是( )
A.Cu、Zn与稀硫酸构成原电池,Cu 作负极
B.粗铜精炼时,纯铜作阳极
C.电解池中,溶液中的阳离子移向阳极
D.原电池的负极、电解池的阳极都发生氧化反应难度: 中等查看答案及解析
-
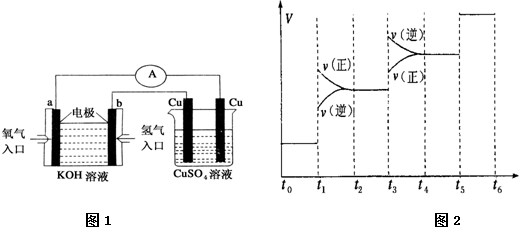
用铂电极电解下列溶液,阴极和阳极上的主要产物为分别为H2和O2的是( )
A.稀NaOH溶液
B.HCl溶液
C.CuSO4溶液
D.酸性AgNO3溶液难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2+Pb+2H2SO4
2PbSO4↓+2H2O,根据此反应判断下列叙述中正确的是( )
A.放电时PbO2是电池的负极
B.放电时,负极的电极反应式为:Pb+SO42-⇌PbSO4+2e-
C.充电时,该电池的正极接电源的负极
D.电池放电时,溶液酸性增强难度: 中等查看答案及解析
-
在2A+B═3C+4D反应中,下面表示的反应速率最快的是( )
A.V(A)=3.0mol•L-1•min-1
B.V(B)=0.2mol•L-1•S-1
C.V(C)=4.8mol•L-1•min-1
D.V(D)=1.0mol•L-1•S-1难度: 中等查看答案及解析
-
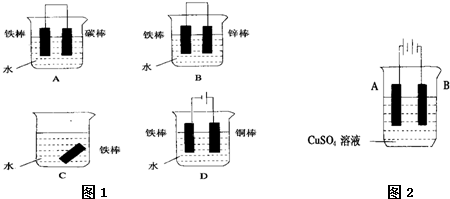
A、B、C是三种金属,根据下列①、②两个实验:
①将A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解;
②电解物质的量浓度相同的A2+、C2+盐溶液时,阴极上先析出C(使用惰性电极).
确定它们的还原性强弱顺序为( )
A.A>B>C
B.B>C>A
C.C>A>B
D.B>A>C难度: 中等查看答案及解析
-
已知下列热化学方程式:
2C(s)+O2(g)═2CO(g)△H=-221kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
由此可知C(s)+H2O(g)═CO(g)+H2(g)△H等于( )
A.-131.3 kJ/mol
B.131.3 kJ/mol
C.373.1 kJ/mol
D.-373.1 kJ/mol难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在密闭容器中,aA(气)⇌bB(气)达平衡后,保持温度不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,下列说法正确的是( )
A.平衡向逆反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b难度: 中等查看答案及解析
-
已知mX(g)+nY(g)⇌gZ(g)的△H<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的密度变小
D.增加X的物质的量,Y的转化率降低难度: 中等查看答案及解析