-
人体内含量最高的金属离子是( )
A.Mg2+
B.Ca2+
C.Na+
D.Fe2+难度: 中等查看答案及解析
-
2012年2月新华网报道,加拿大开发出生产医用放射性同位素
Tc的简单方法.下列关于
Tc的叙述正确的是( )
A.原子序数是99
B.电子数是99
C.中子数是99
D.质量数是43难度: 中等查看答案及解析
-
某元素的某种离子X2-核外共有a个电子,核内有b个中子,表示该X原子的下列符号中正确的是( )
A.X
B.X
C.X
D.X
难度: 中等查看答案及解析
-
下列性质中,不属于金属共同性质的是( )
A.导电、导热性
B.金属光泽
C.熔点较高
D.延展性难度: 中等查看答案及解析
-
等量镁铝合金分别与下列4种过量的溶液充分反应,放出氢气最多的是( )
A.2mol•L-1H2SO4溶液
B.18mol•L-1H2SO4溶液
C.6mol•L-1KOH溶液
D.3mol•L-1HNO3溶液难度: 中等查看答案及解析
-
下列物质中,既含有离子键,又含有共价键的是( )
A.NaOH
B.H2O
C.Na2S
D.CaCl2难度: 中等查看答案及解析
-
在溶液中能大量共存的离子组是( )
A.Al3+、Cl-、Ca2+
B.Mg2+、SO42-、OH-
C.Na+、SO32-、H+
D.Fe3+、SCN-、K+难度: 中等查看答案及解析
-
铁和铁合金是生活中常用的材料,下列说法正确的是( )
A.不锈钢是铁合金,只含金属元素
B.炼铁是铁矿石被还原的过程
C.铁与稀硫酸反应,铁与浓硫酸不反应
D.纯铁比铁合金具有更高的熔点和硬度难度: 中等查看答案及解析
-
下列电子式表示正确的是( )
A.N2的电子式
B.N2的电子式 N≡N
C.NH3的电子式
D.NH3的电子式难度: 中等查看答案及解析
-
下列各组物质的水溶液不用其它试剂无法鉴别的是( )
A.NaOH AlCl3
B.CuSO4BaCl2
C.NaAlO2 HCl
D.MgCl2 NaCl难度: 中等查看答案及解析
-
把铝粉和氧化铁粉配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸起反应;另一份放入足量的烧碱溶液中充分反应.前后两种情况下生成的气体的质量比是( )
A.1:1
B.2:3
C.3:2
D.28:9难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水难度: 中等查看答案及解析
-
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂.下列反应可制取K2FeO4:2Fe(OH)3+3Cl2+10KOH
2K2FeO4+6KCl+8H2O对于该反应,下列说法正确的是( )
A.该反应是置换反应
B.钾元素化合价降低
C.Fe(OH)3发生还原反应
D.Cl2是氧化剂难度: 中等查看答案及解析
-
在通常条件下,下列各组物质的性质排列正确的是( )
A.沸点:CO2>KCl>SiO2
B.稳定性:HF>H2O>NH3
C.熔点:钠>镁>铝
D.水溶性:HCl>H2S>SO2难度: 中等查看答案及解析
-
下列离子方程式中正确的是( )
A.FeCl3溶液跟过量的Zn反应:2 Fe3++3Zn→2Fe+3Zn2+
B.Fe跟稀HNO3反应:2Fe+6H+→2 Fe3++3H2↑
C.Fe2(SO4)3溶液跟Ba(OH)2溶液反应:Fe3++3 OH-→Fe(OH)3↓
D.Cu跟Fe2(SO4)3溶液反应:Cu+Fe3+→Cu2++Fe2+难度: 中等查看答案及解析
-
下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
A B C D X FeCl2溶液 FeCl3溶液 Cl2 Na2SO4溶液 Y FeCl3 CuCl2 HCl Na2CO3 Z Cl2 Fe 饱和食盐水 BaCl2溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
判断下列有关化学基本概念的依据正确的是( )
A.强弱电解质:溶液的导电能力大小
B.氧化还原反应:元素化合价是否变化
C.共价化合物:是否含有共价键
D.金属晶体:熔融晶体是否能够导电难度: 中等查看答案及解析
-
把镁铝合金用稀硫酸溶解,加入氢氧化钠溶液的体积与生成沉淀的质量关系如右图,则合金中镁和铝的质量比是( )
A.1:1
B.8:9
C.4:3
D.4:9难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
A.24g Mg变为Mg2+时失去的电子数为2NA
B.32g O2中含有氧原子的个数为2NA
C.1L 1mol/L NaCl溶液中含有钠离子的个数为NA
D.在标准状况下22.4L H2中含有氢分子的个数为2NA难度: 中等查看答案及解析
-
A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
A.最高价氧化物对应水化物的碱性:C<D
B.气态氢化物的稳定性:A>B
C.四种元素能够在同一周期
D.原子半径:C>A难度: 中等查看答案及解析
-
在同温同压下,等质量的镁、铝、铁分别跟足量的稀盐酸反应,表示反应实际情况的图示正确的是( )
A.
B.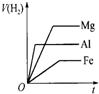
C.
D.
难度: 中等查看答案及解析
-
1999年报道:爆炸性的高能N5+ 阳离子被美国加州爱德华空军基地空军研究室研究的高能材料的化学家Karl O.Christe与他的同事W.W Wilson合成.关于N5+的说法正确的是( )
A.该微粒中的质子数为35
B.该微粒的电子数是34
C.该微粒由5个氮分子构成
D.它是一种由5个氮原子构成的单质分子难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属离子的晶体一定是离子晶体
D.元素的非金属性越强,其单质的活泼性一定越强难度: 中等查看答案及解析
-
在100mL的FeBr2溶液中,通入2.24L的标准状况下的氯气充分反应后,溶液中有1/3的Br被氧化成溴单质.则原FeBr2溶液的物质的量浓度为( )
A.1.0mol/L
B.1.2mol/L
C.1.5mol/L
D.1.8mol/L难度: 中等查看答案及解析
-
分别在pH=2的酸溶液和pH=13的NaOH溶液中加入足量的铝,放出氢气的量前者多,其原因可能是( )
A.两溶液的体积相同,酸是弱酸
B.两溶液的体积相同,酸是多元强酸
C.酸溶液的体积比NaOH溶液体积大
D.酸是强酸,且酸溶液的浓度比NaOH溶液浓度大难度: 中等查看答案及解析
-
某溶液中可能含有下列6种离子中的某几种:Cl-、
、
、
、Na+、K+.为确认溶液组成进行如下实验:
(1)200mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30g,向沉淀中加入过量的盐酸,有2.33g沉淀不溶.
(2)向(1)的滤液中加入足量的NaOH溶液,加热,产生能促使湿润红色石蕊试纸变蓝的气体1.12L(已换算成标准状况,假定产生的气体全部逸出).由此可以得出关于原溶液组成的正确结论是( )
A.一定存在、
、
,可能存在Cl-、Na+、K+
B.一定存在、
、
、Cl-,一定不存在Na+、K+
C.c()=0.01mol,
>
D.如果上述6种离子都存在,则c(Cl-)>难度: 中等查看答案及解析



