-
下列说法正确的是( )
A. 溶质都是固体 B. 乳化能增强乳浊液的稳定性
C. 均一、稳定的液体都是溶液 D. 搅拌可增大物质的溶解度
难度: 中等查看答案及解析
-
将下列物质放入水中,其中一种物质的能量变化与其他三种物质不同的是
A.CaO B.NaOH C.浓H2SO4 D.NH4NO3
难度: 中等查看答案及解析
-
下列物质不属于溶液的是( )
A.生理盐水 B.白醋 C.医用酒精 D.冰水混合物
难度: 简单查看答案及解析
-
下列与洗涤有关的做法不合理的是
A.用洗洁精洗去餐具上的油污
B.用汽油洗去沾在衣服上的油渍
C.用白醋洗去水壶中的水垢(水垢的主要成分是碳酸钙和氢氧化镁)
D.用纯碱溶液洗去铁制品表面的铁锈
难度: 简单查看答案及解析
-
在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图。a、c两点观察到溶液中有固体存在,b点固体完全消失。下列说法不正确的是
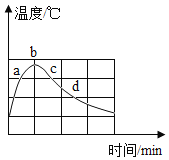
A.NaOH固体溶于水是放热过程 B.a、c两点时,NaOH的溶解度相同
C.b点时,该溶液一定为饱和溶液 D.c点时的溶剂质量等于d点时的溶剂质量
难度: 简单查看答案及解析
-
KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
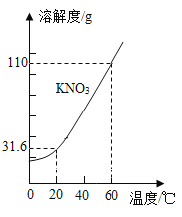
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
难度: 中等查看答案及解析
-
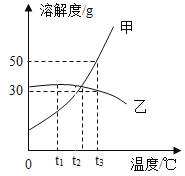
如图为甲、乙两种固体在水中的溶解度曲线。下列说法正确的是( )
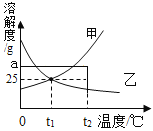
A.甲物质的溶解度比乙物质的大
B.t2℃时,ag甲溶于100g水形成甲的不饱和溶液
C.t1℃时,甲、乙的饱和溶液溶质的质量分数都是25%
D.将t1℃时甲和乙的饱和溶液升温至t2℃,仍然都是饱和溶液
难度: 中等查看答案及解析
-
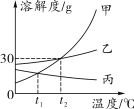
物质a、b的溶解度曲线如图所示,下列判断正确的是( )

A. 60℃时,a、b的溶解度相等,此时由a、b所配制溶液的溶质质量分数也相等
B. 80℃时a溶液的溶质质量分数大于60℃时a溶液的溶质质量分数
C. 在37℃时,将30g的a物质投入50g水中,得到的溶液是饱和溶液
D. 将80℃的等质量的a、b两种物质的饱和溶液分别冷却到60℃得到的晶体质量相等
难度: 中等查看答案及解析
-
如图是甲、乙两种固体物质的溶解度曲线。下列说法中不正确的是( )

A.t1 ℃时,甲和乙的溶解度相同
B.升高温度可以将甲的饱和溶液变为不饱和溶液
C.t2 ℃时,将甲、乙饱和溶液各100 g降温至t1 ℃,析出固体的质量甲>乙
D.t2℃时,75 g甲的饱和溶液加入100 g水,可得到溶质质量分数为20%的溶液
难度: 中等查看答案及解析
-
下图是甲、乙两种固体的溶解度曲线。下列说法不正确的是
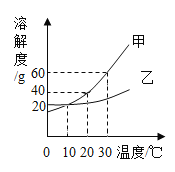
A.10℃时,甲,乙的溶解度相等
B.分别将10℃时甲、乙的饱和溶液升温至20℃,所得溶液的溶质质量分数相等
C.30℃时,向80g甲的饱和溶液中加入70g水,所得溶液溶质质量分数为20%
D.分别将30℃时甲、乙的饱和溶液降温到10℃,甲析出固体质量比乙多
难度: 中等查看答案及解析
-
A、B、C三种物质的溶解度曲线如图所示。下列分析正确的是( )

A.t1℃时,A、C两种物质的饱和溶液中溶质的质量相等
B.将A,B、C三种物质的饱和溶液变为不饱和溶液,可采用升温的方法
C.将 t2℃时A、B、C三种物质的饱和溶液降温至 t1℃,所得溶液的溶质质量分数的大小关系是B>C=A
D.t2℃时,把A、B、C三种物质各25g分别入50g水中均得到饱和溶液,但溶质和溶剂的质量比不相等
难度: 中等查看答案及解析
-
(2019镇江改编)T1 ℃时,将等质量的KNO3、KCl分别加入到各盛有100.0 g水的两个烧杯中,充分搅拌后恢复到T1 ℃,现象如图所示。下列说法正确的是( )
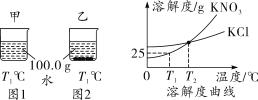
A.甲中加入的固体是KNO3
B.甲中溶液可能是该溶质的饱和溶液,乙中上层清液一定是该溶质的饱和溶液
C.将甲、乙中的物质混合,充分搅拌,一定有固体剩余
D.若将甲、乙的温度从T1 ℃升高到T2 ℃,两溶液中的溶质质量分数不相等
难度: 简单查看答案及解析
-
压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度/℃
10
20
30
60
溶解度/g
KNO3
20.9
31.6
45.8
110
NH3
70
56
44.5
20
A.两种物质的溶解度均随温度升高而增大
B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
难度: 困难查看答案及解析
-
实验室需配制标签如图所示的氯化钠注射液。则下列说法不正确的是

A.配制该注射液的步骤为计算、称量、溶解、量取、装瓶
B.配制该注射液需要氯化钠9 g
C.若量取水时仰视读数,会使所得溶液的溶质质量分数小于0.9%
D.将配制的该溶液稀释为0.5%的氯化钠溶液,需要加水的体积为800mL
难度: 简单查看答案及解析
-
配制50g质量分数5%的KNO3溶液,作为无土栽培所需的营养液,溶解过程中KNO3的质量分数随时间变化关系如图所示,观察图象,分析形成这种结果的原因是( )
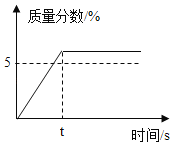
A.所用KNO3固体中含有水分
B.量简量水时俯视刻度线
C.KNO3固体溶解前所用烧杯内有水
D.配好的溶液装瓶时部分液体洒落在试剂瓶外
难度: 中等查看答案及解析

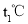 升温到
升温到 ,所得溶液的溶质质量分数为甲____________(选填“大于”“小于”或“等于”)乙;
,所得溶液的溶质质量分数为甲____________(选填“大于”“小于”或“等于”)乙; 时,向
时,向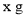 甲的饱和溶液中加入100
甲的饱和溶液中加入100 水得到20%的溶液,则
水得到20%的溶液,则 ____________。
____________。