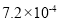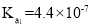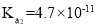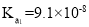-
下列物质中,化学式能真正表示该物质分子组成的是( )
A. SiO2 B. S C. KOH D. H2SO4
难度: 困难查看答案及解析
-
下列能级中,能级符号正确且轨道数为5的是( )
A.2d B.3p C.4d D.5s
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.NaHSO4在熔融状态下电离与在水中电离时,破坏的化学键完全相同
B.H2O比H2S分子稳定,是因为H2O分子间能形成氢键
C.NaCl和HCl气化时,克服的作用力不相同,故沸点不同
D.碘沸点低、易升华,是因为分子中的 I﹣I键能较小
难度: 中等查看答案及解析
-
下列关于原子核外电子排布与元素在周期表中位置关系的叙述正确的是( )
A.基态原子核外N电子层上只有一个电子的元素一定是第ⅠA族元素
B.原子核外价电子排布式为(n-1)d6~8ns2的元素一定是副族元素
C.基态原子的p能级上半充满的元素一定位于p区
D.基态原子核外价电子排布式为(n-1)dxnsy的元素的族序数一定为x+y
难度: 中等查看答案及解析
-
不能说明X的电负性比Y的大的是
A.X原子的最外层电子数比Y原子的最外层电子数多
B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强
C.与H2化合时X单质比Y单质容易
D.X单质可以把Y从其氢化物中置换出来
难度: 简单查看答案及解析
-
用短线“—”表示共用电子对,用“··”表示未成键孤电子对的式子叫路易斯结构式。R分子的路易斯结构式可以表示为
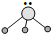 则以下叙述错误的是( )
则以下叙述错误的是( )A.R为三角锥形 B.R可以是BF3
C.R是极性分子 D.键角小于109°28′
难度: 简单查看答案及解析
-
S2Cl2是橙黄色液体,少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液。其分子结构如图所示。下列关于S2Cl2的说法中错误的是

A.S2Cl2为非极性分子
B.分子中既含有极性键又含有非极性键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.S原子采用sp3杂化
难度: 简单查看答案及解析
-
下列关于苯乙炔的说法错误的是 ( )
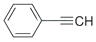
A.该分子有8个σ键,5个π键
B.该分子中碳原子有sp和sp2杂化
C.该分子存在非极性键
D.该分子中有8个碳原子在同一平面上
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.用硝酸铜溶液代替硫酸铜溶液进行实验,不能观察到同样的现象
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
下列有关性质的比较中,不正确的是
A.硬度由大到小:金刚石>碳化硅>晶体硅 B.晶格能:NaBr<NaCl<MgO
C.键的极性:N-H<O-H<F-H D.在水中的溶解度:NH3>CO2>SO2>H2
难度: 简单查看答案及解析
-
在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6的配合物,分别取0.01mol两种晶体在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的
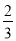 ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )A.该绿色晶体配体是氯离子和水,它们物质的量之比为1:5
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.78g沉淀
难度: 困难查看答案及解析
-
有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数的值,下列说法错误的是
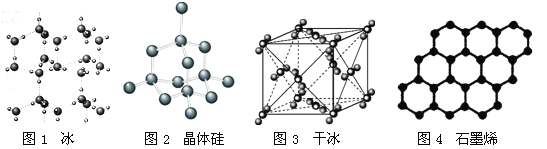
A.18g冰(图1)中含O—H键数目为2NA
B.28g晶体硅(图2)中含有Si—Si键数目为2NA
C.44g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C—C键数目为1.5NA
难度: 中等查看答案及解析
-
用蒸馏水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.c(OH-)/c(NH3·H2O) B.n(OH-) C.c(NH3·H2O)/c(H+) D.c(H+)
难度: 简单查看答案及解析
-
电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是( )
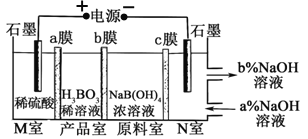
A.M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B.a、c为阴离子交换膜,b为阳离子交换膜
C.N室中:a%<b%
D.理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
难度: 困难查看答案及解析
-
aA(g)+bB(g)
 cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是( )
cC(g)+dD(g) ΔH=Q,同时符合下列两图中各曲线的规律是( )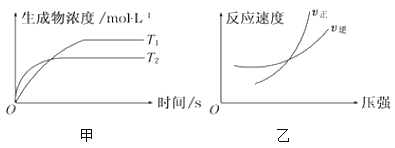
A.a+b>c+d T1>T2 Q>0 B.a+b>c+d T1<T2 Q<0
C.a+b<c+d T1<T2 Q>0 D.a+b>c+d T1>T2 Q<0
难度: 中等查看答案及解析
-
常温下,HCOOH和CH3COOH的电离常数分别1.80×10−4和1.75×10−5。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg
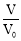 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中
 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)D.若两溶液无限稀释,则它们的c(H+)相等
难度: 中等查看答案及解析
-
物质间常常相互联系、互相影响中,微粒也不例外。下列各组离子可能大量共存的是
A.常温下水电离出的c(H+)=1×10-10 mol•L-1的溶液中:Na+、Cl-、S2-、SO
B.不能使酚酞试液变红的无色溶液中:Na+、CO
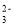 、ClO-、Al3+
、ClO-、Al3+C.能与金属铝反应放出氢气的溶液中:K+、CO
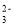 、Cl-、NH
、Cl-、NH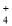
D.无色透明溶液:K+、HCO
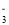 、SO
、SO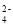 、Fe3+
、Fe3+难度: 简单查看答案及解析
-
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)
 Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表:温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法不正确的是
A. 上述生成Ni(CO)4(g)的反应为放热反应
B. 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时V(正)>V(逆)
C. 25℃时反应Ni(CO)4(g)
 Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3
Ni(s)+4CO(g)的平衡常数为2×10-5 (mol·L-1)3D. 80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度2 mol/L。
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.某温度Ksp(Ag2S)=6
 10-50(mol·L-1)3,Ksp(AgCl)=2
10-50(mol·L-1)3,Ksp(AgCl)=2 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ⇌Ag2S(s)+2Cl-(aq)的平衡常数约为6.7
10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ⇌Ag2S(s)+2Cl-(aq)的平衡常数约为6.7 1037mol·L-1
1037mol·L-1B.pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C.pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
D.一定浓度的NaHS溶液中存在:c(Na+)=c(S2-)+c(HS-)+c(H2S)
难度: 中等查看答案及解析
-
T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示,则下列结论正确的是
A.容器中发生的反应可表示为3X(g)+Y(g)
 2Z(g)
2Z(g)B.反应进行的前3min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D.保持其他条件不变,升高溫度,反应的化学平衡常数K增大
难度: 中等查看答案及解析
 2NH3(g) △H = -92.4kJ/mo1, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) △H = -92.4kJ/mo1, 将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ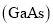 太阳能电池为我国“玉兔二号”月球车提供充足能量;GaN手机快充充电器受到广大消费者的喜爱。
太阳能电池为我国“玉兔二号”月球车提供充足能量;GaN手机快充充电器受到广大消费者的喜爱。 。
。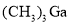 和
和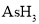 反应制得。在常温常压下,
反应制得。在常温常压下, 填“有”或“无”
填“有”或“无” 配位键存在。GaN、GaP、GaAs具有相同的晶体类型,熔点如下表所示,分析其变化原因:______。
配位键存在。GaN、GaP、GaAs具有相同的晶体类型,熔点如下表所示,分析其变化原因:______。
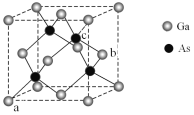
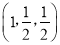 ,则c原子的坐标参数为_____。
,则c原子的坐标参数为_____。 2H2(g)+O2(g)。
2H2(g)+O2(g)。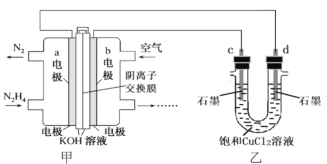
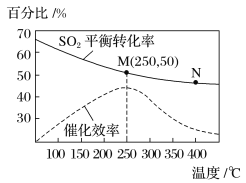
 2CO2(g)+S(g) ΔH,测得温度对SO2的转化率及催化剂效率的影响如图所示:
2CO2(g)+S(g) ΔH,测得温度对SO2的转化率及催化剂效率的影响如图所示: