-
已知,一些铅盐的溶度积如下:
化合物
PbSO4
PbCO3
PbS
PbCl2
溶度积Ksp
1.82×10-8
1.46×10-13
9.04×10-29
1.17×10-5
由上述数据可知,要除去工业废水中的Pb2+,沉淀剂最好选用( )
A.硫酸盐 B.硫化物 C.碳酸盐 D.盐酸盐
难度: 简单查看答案及解析
-
化学与生活、社会发展息息相关。下列说法错误的是( )
A.燃料电池的能量转化率可达100%
B.用可溶性的铝盐或铁盐处理水中的悬浮物
C.金属焊接时,可用NH4Cl溶液作除锈剂
D.食品中用木糖醇作甜味剂,可降低糖尿病的发病率
难度: 简单查看答案及解析
-
把NaHCO3作为发酵粉使用时,往往加入少量的明矾,这是因为明矾
A.在水中能起到酸的作用 B.受热分解能放出气体
C.具有净水剂的作用 D.能起催化剂的作用
难度: 中等查看答案及解析
-
下列有关糖类、油脂、蛋白质说法正确的是
A.糖类、油脂、蛋白质都能发生水解反应
B.植物油通过氢化可以变为脂肪
C.纤维素和淀粉遇碘水均显蓝色
D.醋酸铅可用于分离、提纯蛋白质
难度: 简单查看答案及解析
-
下列说法正确的是
A.提纯固态有机物常采用重结晶法,提纯液态有机物常采用蒸馏法
B.粮食酿酒是淀粉直接转化为乙醇的化学变化过程
C.聚乙烯塑料的老化是因为发生了加成反应
D.汽油应该盛放在带橡胶塞的试剂瓶中
难度: 中等查看答案及解析
-
下表为某有机物与几种试剂反应的现象,这种有机物可能是
试剂
钠
溴水
NaHCO3溶液
现象
放出气体
褪色
放出气体
A.乙酸乙酯 B.丙烯醇 C.丙烯酸 D.苯酚
难度: 中等查看答案及解析
-
在制备和纯化溴苯的实验过程中,下列操作未涉及的是
A.
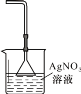 B.
B. 
C.
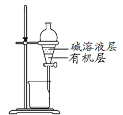 D.
D.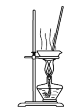
难度: 简单查看答案及解析
-
下列操作能达到实验目的的是
目的
操作
A
实验室配制FeCl3水溶液
将FeCl3溶于少量浓盐酸中,再加水稀释
B
制备乙酸乙酯
在试管中加入2 mL乙醇和2 mL乙酸,加热
C
配制银氨溶液
向盛有1 mL 2%稀氨水的试管中加入过量AgNO3溶液
D
除去MnCl2酸性溶液中的Fe3+
加入过量MnO2充分搅拌,过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A.异丙苯中碳原子可能都处于同一平面
B.化合物(CH3CH2)2CHCH3的名称为2-乙基丁烷
C.光照下,Cl2可在甲苯的苯环或侧链上发生取代反应
D.苯乙烯(
 )和立方烷(
)和立方烷(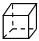 )互为同分异构体
)互为同分异构体难度: 简单查看答案及解析
-
在化学式为C6H13Cl的分子中,含有三个甲基的同分异构体的数目是(不含立体异构)
A.7种 B.8种 C.9种 D.10种
难度: 中等查看答案及解析
-
已知:电流效率=电路中通过的电子数÷消耗负极材料失去电子总数。现有三个电池装置如图所示:
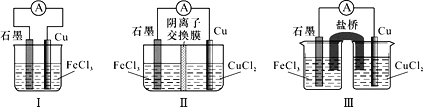
下列说法正确的是
A.Ⅰ、Ⅱ和Ⅲ的电池反应均为:Cu+Fe3+=Cu2++Fe2+
B.Ⅲ中烧杯里的Cl-从右池经过盐桥移向左池
C.5min后,Ⅰ、Ⅱ和Ⅲ中都只含两种溶质
D.Ⅱ、Ⅲ的电流效率均高于Ⅰ的电流效率
难度: 简单查看答案及解析
-
常温下,下列各组离子在相应的溶液中可能大量共存的是
A.能使pH试纸变红的溶液中:CO
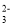 、K+、Cl-、Na+
、K+、Cl-、Na+B.由水电离产生的c(OH-)=1×10-10 mol·L-1的溶液中:NO
 、Mg2+、Na+、SO
、Mg2+、Na+、SO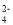
C.在
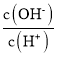 =1×1012的溶液中:NH
=1×1012的溶液中:NH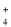 、Fe2+、Cl-、NO
、Fe2+、Cl-、NO
D.
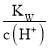 =10-10mol·L-1的溶液中:Na+、HCO
=10-10mol·L-1的溶液中:Na+、HCO 、Cl-、K+
、Cl-、K+难度: 简单查看答案及解析
-
丁烷广泛应用于家用液化石油气,也用于打火机中作燃料,下列叙述中不正确的是
A.丁烷在常温下是气体
B.C4H10与C(CH3)4互为同系物
C.CH3CH2CH2CH3分子中四个碳原子排列成一条直线
D.C4H10进行一氯取代后可生成四种沸点不同的有机产物
难度: 简单查看答案及解析
-
常温下,向100 mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L NaOH溶液,混合溶液的pH变化情况如如图所示。下列判断正确的是
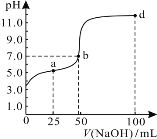
A.由图中信息可知,HA可能为强酸
B.a点对应的溶液中:2c(Na+)=c(A-)+c(HA)
C.b点对应的溶液中:c(Na+)=c(A-)+c(HA)
D.d点所对应的溶液中离子浓度的大小关系为: c(Na+)>c(A-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.18.0 g葡萄糖所含羟基数为0.5NA
B.标准状况下,2.24 L 戊烷所含原子数为1.7NA
C.0.5 mol明矾水解形成的胶体粒子数为0.5NA
D.1 L 0.1 mol·L-1的NaClO溶液中含有ClO-的数目为0.1NA
难度: 中等查看答案及解析
-
“重油—氧气—熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是
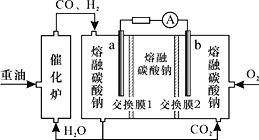
A.O2在b极得电子,最终被还原为
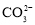
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,
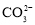 经“交换膜2”移向b极
经“交换膜2”移向b极D.H2参与的电极反应为:
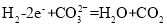
难度: 中等查看答案及解析
-
已知:pBa2+=-lgc(Ba2+),pKa=-lgKa。向20 mL 0.1 mol/L BaCl2溶液中滴加0.2 mol/L Na2CO3溶液的滴定曲线如图所示。下列描述错误的是
(常温下,H2CO3的电离常数pKa1=6.4,pKa2=10.3;Ksp(BaSO4) =1.1×10-10。)

A.在碳酸钠溶液中,Kh1(CO
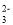 )=1.0×10-3.7
)=1.0×10-3.7B.根据曲线数据计算可知Ksp(BaCO3)的数量级为10-9
C.相同条件下,若改为0.15 mol/L BaCl2溶液,反应终点F移到K点
D.相同条件下,若改为0.2 mol/L Na2SO4溶液,反应终点F向H方向移动
难度: 中等查看答案及解析
 ⑤
⑤ 
 2AgCl(s)+CrO
2AgCl(s)+CrO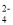 (aq)的平衡常数K=________,由此可见,溶度积小的Ag2CrO4也容易转化为溶度积较大的AgCl。
(aq)的平衡常数K=________,由此可见,溶度积小的Ag2CrO4也容易转化为溶度积较大的AgCl。
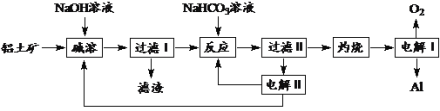
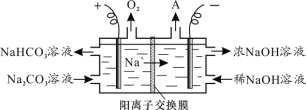

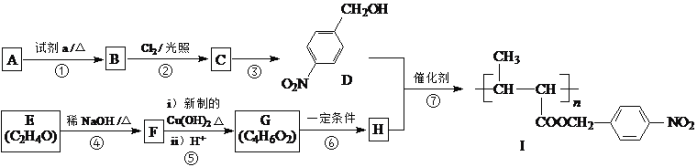
 RCH=CHCHO+H2O。
RCH=CHCHO+H2O。