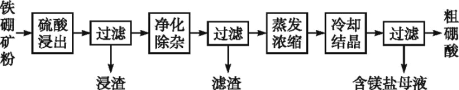
-
化学与生产生活社会密切相关。下列说法正确的是
A.一次性医用外科口罩的核心功能层熔喷布以纯净物聚丙烯为主要原料制成
B.在“新冠肺炎战疫”中,将84消毒液和医用酒精混合使用,消毒效果更佳
C.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
难度: 中等查看答案及解析
-
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X的一种核素在考古时常用来鉴定一些文物的年代,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A.化合物XZ2各原子均满足8电子的稳定结构
B.已知含氧酸的酸性:H2ZO3>H2XO3,则Z的非金属性强于X
C.若单质W失火,不能用泡沫灭火器扑灭
D.通常采用电解法制备单质Y及其同周期的金属单质
难度: 中等查看答案及解析
-
下列说法不正确的有几个
①质子数相同的微粒一定属于同一种元素②同一元素的核素种数由中子数决定③18gH2O中含有的中子数为8NA④标准状况下,等体积CH4和SO3所含的分子数相同⑤通过化学变化可以实现16O与18O之间的相互转化
A.2个 B.3个 C.4 个 D.5 个
难度: 简单查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A.
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C.
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
化学与生产、生活有关,下列说法正确的是
A.将淀粉在稀硫酸中水解的最终产物与银氨溶液混合,水浴加热后可出现光亮的银镜
B.蔗糖和麦芽糖互为同分异构体,两者水解产物可与新制的 Cu(OH)2 悬浊液反应
C.向鸡蛋清溶液中加入少量 CuSO4 溶液出现浑浊,说明蛋白质发生了盐析
D.尼龙绳、宣纸、棉衬衣这些生活用品中都主要由合成纤维制造
难度: 简单查看答案及解析
-
类推的思维方法在化学学习和研究中有时会产生错误的结论,因此类推出的结论最终要经 过实践的检验才能决定其正确与否。下列几种类推结论中正确的是
A.第ⅣA 族 CH4 的沸点低于 SiH4,则第ⅦA 族 HF 的沸点也低于 HCl
B.可电解熔融 MgCl2 来制取金属镁,则也可电解熔融 AlCl3 来制取金属铝
C.第二周期元素氢化物稳定性顺序是 HF>H2O>NH3,则第三周期元素氢化物稳定性顺序也是 HCl>H2S>PH3
D.CO2 通入 Ba(NO3)2 溶液中不能生成沉淀,SO2 通入 Ba(NO3)2 溶液中也不能生成沉淀
难度: 中等查看答案及解析
-
C60具有广泛的应用前景,可以与金属K形成碳球盐K3C60,K3C60具有良好的超导性;也可以与H2反应生成C60H36,在80℃~215℃时,C60H36便释放出氢气,可作储氢材料。下列说法正确的是
A.C60H36释放出氢气的过程中,只破坏分子间作用力
B.C60融化时破坏的是共价键
C.K3C60中既存在离子键,又存在共价键
D.在熔融状态下,K、K3C60、C60、C60H36四种物质中只有K3C60能导电
难度: 中等查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的短周期元素,其中W原子的质子数是其M层电子数的三倍,Z 与 W、X 与 Y 相邻,X 与 W 同主族。下列说法不正确的是
A.原子半径:Z>W>X>Y
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:X>W,因为 X 的最简单气态氢化物存在分子间氢键
D.元素 X、Z、W 的最高化合价分别与其主族序数相等
难度: 中等查看答案及解析
-
下列说法正确的是
A.升高温度或加入催化剂,可以改变化学反应的反应热
B.Ag+(aq)+Cl-(aq)=AgCl(s),该反应活化能几乎为0
C.化学反应中的能量变化都是以热量的形式体现
D.2CO(g)+O2(g)=2CO2(g) △H<0,则 56g CO和32g O2所具有的总能量小于88g CO2所具有的总能量
难度: 简单查看答案及解析
-
二羟基甲戊酸的结构简式为
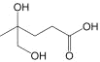 ,下列有关二羟基甲戊酸的说法正确的是
,下列有关二羟基甲戊酸的说法正确的是A.二羟基甲戊酸的分子式为C5H10O4
B.二羟基甲戊酸能使酸性KMnO4溶液褪色
C.等物质的量的二羟基甲戊酸消耗Na和NaHCO3的物质的量之比为1∶1
D.二羟基甲戊酸与乳酸(
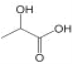 )互为同系物
)互为同系物难度: 简单查看答案及解析
-
化合物
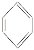 (b)、
(b)、 (d)、
(d)、 (p)的分子式均为C6H6,下列说法正确的是
(p)的分子式均为C6H6,下列说法正确的是A.b 的同分异构体只有d和p两种
B.b、d、p的二氯代物均只有三种
C.b、d、p中只有d可与酸性高锰酸钾溶液反应
D.b、d、p中只有p的所有原子不处于同一平面
难度: 中等查看答案及解析
-
下列关于有机物的说法中,正确的一组是
①“乙醇汽油”是在汽油里加入适量乙醇而成的一种燃料,它是一种新型化合物
②汽油、柴油和植物油都是碳氢化合物,完全燃烧只生成 CO2 和 H2O
③石油的分馏、煤的气化和液化都是物理变化
④除去 CH4 中混有的少量 CH2=CH2,可将混合气体通过盛有溴水的洗气瓶
⑤将 ag 铜丝灼烧成黑色后趁热插入乙醇中,铜丝变红,再次称量质量等于ag
A.④⑤ B.①④ C.②⑤ D.①②③
难度: 中等查看答案及解析
-
已知:①C(s、金刚石)+ O2(g)= CO2(g) ΔH1=-395.4 kJ•mol-1,② C(s、石墨) + O2(g)= CO2(g) ΔH2=-393.5 kJ•mol-1,上述反应中的能量变化如图所示,下列说法错误的是
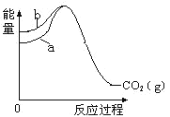
A.石墨和金刚石之间的转化是化学变化 B.图中b代表反应①的能量变化
C.C(s、金刚石)=C(s、石墨) ΔH= +1.9 kJ•mol-1 D.石墨比金刚石的热稳定性好
难度: 简单查看答案及解析
-
在 25℃和 101kPa 的条件下:
化学键
H—H
Cl—Cl
H—Cl
键能(kJ/mol)
436
243
431
对于反应 H2(g)+Cl2(g)=2HCl(g)的能量变化描述正确的是
A.断开 1molH2 中的 H—H 键需要放出 436kJ 的能量
B.生成 2molHCl 中的 H—Cl 键需要放出 431kJ 的能量
C.H2(g)+Cl2(g)=2HCl(g) △H=-183 kJ•mol-1
D.2molHCl(g)的能量比 1molH2(g)和 1molCl2(g)的总能量高
难度: 中等查看答案及解析
-
一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为99.2 g,当其缓慢经过无水CaCl2时,CaCl2增重50.4g。原混合气体中CO的质量为( )
A.13.2 g B.22.4g C.24.4g D.26.4g
难度: 困难查看答案及解析
-
某研究性学习小组所做的石蜡油(17个碳原子以上的烷烃)分解实验如图所示。下列有关说法正确的是
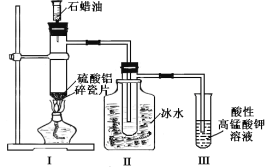
A.装置II中逸出的气体通入高锰酸钾溶液,发生加成反应
B.石蜡油分解生成的气体中只有烯烃
C.十八烷完全分解为乙烷和最多乙烯时,二者物质的量之比为1:8
D.装置I中硫酸铝和碎瓷片都是催化剂
难度: 困难查看答案及解析
-
将铝粉与某铁的氧化物FeO·2Fe2O3粉末配制成铝热剂,分成两等份。一份直接放入足量的烧碱溶液中,充分反应后放出气体在标准状况下的体积为3.92 L;另一份在高温下恰好反应完全,反应后的混合物与足量的盐酸反应后,放出的气体在标准状况下的体积为
A.2.80 L B.3.92 L C.5.60 L D.7.84 L
难度: 中等查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),下列有关说法错误的是
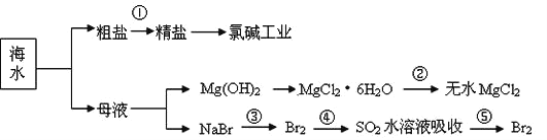
A.第①步中除去粗盐中的
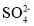 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:BaCl2溶 液→Na2CO3溶液→NaOH 溶液→过滤→适量盐酸调 pH通电
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:BaCl2溶 液→Na2CO3溶液→NaOH 溶液→过滤→适量盐酸调 pH通电B.氯碱工业发生的主要反应为:2NaCl+2H2O====2NaOH+H2↑+Cl2↑
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③⑤步中溴元素均被还原
难度: 中等查看答案及解析
-
CO2 和 CH4 催化重整可制备合成气,对减缓燃料危机具有重要意义,其反应历程示意图如图:
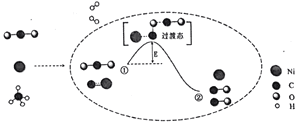
下列说法正确的是
A.合成气的主要成分为 CO B.①→②过程可表示为 CO2+NiC=2CO+Ni
C.①→②过程吸收能量 D.Ni在该反应中是中间产物
难度: 中等查看答案及解析
-
在298K、1.01×105Pa下,将 0.5molCO2 通入750mL1mol·L-1NaOH溶液中充分反应,测得反应放出 ykJ 的热量。已知在该条件下,1molCO2 通入1L 2mol·L-1NaOH溶液中充分反 应放出 xkJ 的热量,则 CO2 与 NaOH 溶液反应生成 NaHCO3 的热化学方程式正确的是
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.CO2(g)+NaOH(l)=NaHCO3(l) ΔH=-(4x-y)kJ·mol-1
难度: 中等查看答案及解析