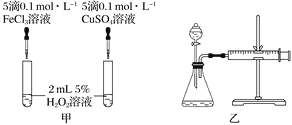
-
下列有关反应速率的说法中正确的是( )
A. 氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率
B. 等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C. 用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率
D. 二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
难度: 中等查看答案及解析
-
S16O2与18O2在高温条件下发生反应2SO2+O2
 2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )
2SO3,达到化学平衡后,平衡混合物中含18O的微粒( )A.只有SO3 B.只有SO2、SO3 C.有SO2、SO3、O2 D.只有O2、SO3
难度: 简单查看答案及解析
-
COCl2(g)⇌CO(g)+Cl2(g)∆H>0,当反应达到平衡时,下列措施:①升温,②恒压通入惰性气体,③增加CO的浓度,④减压,⑤加催化剂,⑥恒容通入惰性气体;能提高COCl2转化率的是( )
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
高温下,某反应达到平衡,平衡常数K=
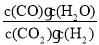 。恒容时,温度升高,H2浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2浓度减小。下列说法正确的是( )A.该反应是焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O
 CO2+H2
CO2+H2难度: 中等查看答案及解析
-
在一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)
 xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol•L-1。下列判断错误的是
xC(g)+2D(g)。2min末该反应达到平衡,生成0.8molD,并测得C的浓度为0.2mol•L-1。下列判断错误的是A.x=1 B.若混合气体的密度不变则表明该反应达到平衡状态
C.B的转化率为40% D.2min内A的反应速率为0.3mol•L-1•min-1
难度: 中等查看答案及解析
-
下列关系中能说明反应N2(g)+3H2(g)
 2NH3(g)已经达到平衡状态的是( )
2NH3(g)已经达到平衡状态的是( )A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
下列图中,表示2A(g)+B(g)⇌ 2C(g) ΔH<0可逆反应的图像为
A.
 B.
B.
C.
 D.
D.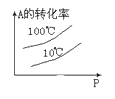
难度: 中等查看答案及解析
-
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z2)=0.4 mol·L-1,则该反应的化学方程式可表示为( )
A.X2+2Y2=2XY2 B.2X2+Y2=2X2Y
C.3X2+Y2=2X3Y D.X2+3Y2=2XY3
难度: 中等查看答案及解析
-
已知下列反应的平衡常数:H2(g)+S(s)
 H2S(g),K1;S(s)+O2(g)
H2S(g),K1;S(s)+O2(g)  SO2(g),K2。则反应H2(g)+SO2(g)
SO2(g),K2。则反应H2(g)+SO2(g)  O2(g)+H2S(g)的平衡常数为( )
O2(g)+H2S(g)的平衡常数为( )A.K1+K2 B.K1-K2 C.K1×K2 D.

难度: 中等查看答案及解析
-
可逆反应A(g)+B
 C(g)+D,达到平衡时,下列说法不正确的是
C(g)+D,达到平衡时,下列说法不正确的是A.若B是气体,增大A的浓度会使B的转化率增大
B.若增大A的浓度,平衡体系颜色加深,D不一定是有颜色的气体
C.升高温度,C质量分数减少,说明正反应为放热反应
D.增大压强,平衡不移动,说明B、D一定是气体
难度: 中等查看答案及解析
-
一定温度下,向某容积恒定的密闭容器中充入1 mol N2、3 mol H2,经充分反应后达到平衡,下列有关说法正确的是( )
A.平衡时n(N2):n(H2):n(NH3)=1:3:2
B.平衡时混合气体中N2的物质的量分数可能为26%
C.没有达到平衡时,NH3会不断地分解,达到平衡时则不再分解
D.平衡时NH3的体积分数保持不变
难度: 中等查看答案及解析
-
在密闭容器中进行反应X2(g)+Y2(g)
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.2 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是A.Z为0.2 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.3 mol·L-1 D.Z为0.4 mol·L-1
难度: 中等查看答案及解析
-
在密闭容器中发生反应m A(g)+n B(g)
 p C(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是
p C(g),达到平衡后,保持温度不变,将气体体积缩小到原来的1/2,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是A.m+n>p B.平衡向逆反应方向移动
C.A的转化率提高 D.C的体积分数增加
难度: 中等查看答案及解析
-
反应 C(s)+ H2O (g)
 CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )
CO (g)+H2 (g) △H>0 在某一时间段中反应速率与反应过程的曲线关系如图,下列说法正确的是( )
A.CO的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段H2的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
难度: 简单查看答案及解析
-
一定温度下,某密闭容器中存在如下反应A(g)+xB(g)
 2C(g),反应过程中有关量值变化如下图所示,下列说法中错误的是( )
2C(g),反应过程中有关量值变化如下图所示,下列说法中错误的是( )
A.30 min时扩大了容器的容积
B.首次平衡时的K=4
C.40 min时增大了压强
D.8 min前A的平均反应速率为0.8 mol/(L·min)
难度: 中等查看答案及解析
-
Ni(CO)4可用于有机合成,也常用作催化剂。一定条件下,恒容密闭容器中发生反应Ni(s)+4CO(g)
 Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:
Ni(CO)4(g),该反应的平衡常数与温度的关系如下表所示:温度/℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法正确的是
A.25℃达到平衡时,向容器中继续充入CO(g),CO的转化率减小
B.温度越低,越有利于Ni(CO)4的生产
C.80℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正<v逆
D.平衡后,向密闭容器中加入少量镍粉,平衡正向移动,达到新平衡时CO的浓度比原平衡小
难度: 中等查看答案及解析
 填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。 ” p)。
” p)。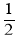 O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。