-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,8 g CH4完全燃烧生成液态水时放出的热量是445.15 kJ,则CH4燃烧的热化学方程式是 。
(2)已知:C(s) + O2(g)  CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
H2(g) + 1/2 O2(g)  H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g) + 1/2 O2(g)  CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则煤的气化主要反应的热化学方程式是:C(s) + H2O(g)  CO(g) + H2(g) ΔH= kJ•mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ•mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
已知反应N2+3H2  2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
2NH3 △H=a kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,2gC2H2(g)完全燃烧生成液态水时放出的热量是100kJ,则C2H2燃烧的热化学方程式是_________________________ 。
(2)已知:C(石墨,s)+O2(g) = CO2(g) △H = —393.5kJ·mol—1,C(金刚石,s)+ O2(g) =CO2(g) △H =—395.0kJ·mol—1,则反应C(石墨,s) = C(金刚石,s) △H =______kJ·mol—1。由此可知,石墨和金刚石相比更稳定的是 _______(填“石墨”或“金刚石”)。
(3)已知H2(g)的燃烧热△H 1=—285.0kJ·mol—1,CO(g)的燃烧热△H 2=—283.0kJ·mol—1, CH3OH(l)的燃烧热△H3=—726.0kJ·mol—1。0.2mol由H2 和CO组成的混合气体在完全燃烧时放出56.8kJ的能量,则混合气体中H2 和CO的质量比为_________。工业上在催化剂的作用下,可用H2(g)和CO(g)合成CH3OH(l)。请写出由H2(g)和CO(g)合成CH3OH(l)的热化学方程式:_______________________。
(4)强酸和强碱的稀溶液的中和热可表示为 H+ (aq)+OH— (aq) = H2O(l) △H =—57.3kJ·mol—1。已知:CH3COOH(aq)+NaOH(aq) = CH3COONa(aq)+H2O(l) △H =—33.1kJ·mol—1。请写出醋酸溶液电离的热化学方程式:_______________。
-
能源是经济增长与社会发展的重要物质基础,美国马奇蒂博士对世界一次能源替代趋势曾作如下预测:
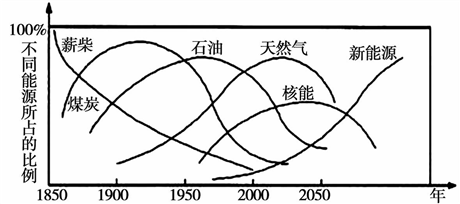
回答下列问题:
(1)上图化石能源中属于较清洁的能源是_________。
(2)核电厂的燃料一般由0.71%235U、99.28%238U及0.0058%234U组成
①235U、238U、234U三种核素之间的关系是______________。
②235g核素 发生裂变反应:
发生裂变反应: 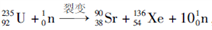 ,净产生的中子
,净产生的中子 数为_______。
数为_______。
(3)下图是氢能的制备及利用的途径之一,涉及能量转化方式有___________。(填代号)
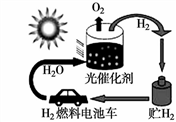
a光能→化学能 b电能→化学能 c化学能→电能
(4)目前实现煤的综合利用的主要途径是煤的干馏、煤的气化和液化。
①煤的干馏属于变化______________。(填物理或化学)
②煤的气化过程发生的主要反应是____________。
(5)可燃冰属于新能源,我国是全球第一个成功稳定开采可燃冰的国家。某种可燃冰(甲烷水合物)晶体中,平均每46个水分子构成8个分子笼,每个分子笼可容纳1个甲烷分子或水分子,若这8个分子笼中有6个容纳的是甲烷分子,另外2个被水分子填充,则这种可燃冰的平均组成可表示为____________。
-
下列说法中,错误的是( )
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三大化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
-
下列说法中,错误的是
A.人类目前直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
-
下列说法中,不正确的是
A. 人类目前直接利用的能量大部分是由化学反应产生的
B. 煤、石油、天然气是当今世界重要的三种化石燃料
C. 我国目前最主要的能源是煤炭
D. 人体运动所消耗的能量与化学反应无关
-
下列说法中,不正确的是
A.人类目前直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
-
下列说法中,不正确的是( )
A.人类目前直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
-
下列说法,错误的是( )
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
-
下列说法中,错误的是
A、我国目前最主要的能源是煤炭
B、人体运动所消耗的能量与化学反应无关
C、煤、石油、天然气是当今世界最重要的三种化石燃料
D、人类目前所直接利用的能量大部分是由化学反应产生的
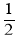 O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH2=-241.8 kJ·mol-1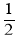 O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH3=-283.0 kJ·mol-1 CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-198 kJ·mol-1。
 CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
CH3OCH3(g)+H2O(g)达到平衡。反应过程中测得的部分数据见下表:
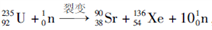 ,净产生的中子
,净产生的中子