-
生活中常用到一些化学知识,下列分析中正确的是 ( )
A. NaHCO3能与碱反应,所以可用作焙制糕点的膨松剂
B. 加碘食盐中添加碘酸钾而不用碘化钾,是因为碘酸钾能溶于水而碘化钾不溶于水
C. 焰火的五彩缤纷是某些金属元素化学性质的展现
D. 民间常用明矾作净水剂,目的是除去水中的悬浮杂质
难度: 中等查看答案及解析
-
大多数物质的俗名是根据其特殊的物理性质或用途得来的。下列物质的俗名与化学式或用途不相符的一项是
选项
俗名
主要成分(化学式)
用途
A
石英
SiO2
集成电路
B
纯碱
Na2CO3
制备玻璃
C
水玻璃
Na2SiO3
制备硅胶
D
铁红
Fe2O3
用作油漆和涂料
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
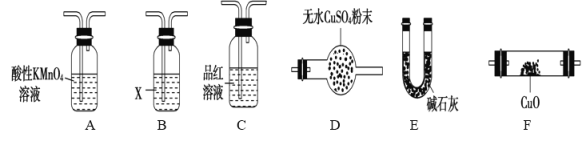
用下列实验装置进行相应实验,能达到实验目的的是( )
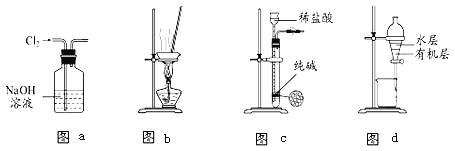
A. 用图(a)所示装置除去Cl2中含有的少量HCl
B. 用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图(c)所示装置制取少量纯净的CO2气体并控制反应的发生和停止
D. 用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
根据下列实验事实判断所测液体样品最有可能是纯水的是( )
A. 一定温度下,测定其pH等于7
B. 一个标准大气压下,测定其沸点为100℃
C. 电解,产生H2、O2的体积比为2:1
D. 室温时为无色、无味的液体
难度: 中等查看答案及解析
-
下列有关苯乙烯(
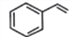 )的说法错误的是
)的说法错误的是A. 苯乙烯与乙烯互为同系物
B. 所有原子可能在同一平面
C. 可使酸性KMnO4溶液褪色
D. 可发生加成反应
难度: 中等查看答案及解析
-
下列化学方程式或离子方程式正确的是
A. 苏打溶液与过量的澄清石灰水反应:Ca2++OH-+HCO3-= CaCO3↓+H2O
B. 少量SO2通入氢氧化钠溶液中:OH-+SO2=HSO3-
C. 双氧水作脱氯剂,用于消除水中的氯气:Cl2+H2O2=2HCl+O2
D. FeI2溶液中通入一定量的氯气:2Fe2++2I-+ 2Cl2 = 2Fe3++I2+ 4Cl-
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、W 处于同一主族,Y、Z的原子最外层电子数之和等于9,X的简单氢化物与W的单质组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. 简单离子半径: Y<Z<W
B. W的氧化物对应的水化物的酸性一定比X的强
C. Y的简单气态氢化物的热稳定性一定比W的强
D. Y分别与X、Z形成的化合物,其所含化学键的类型相同
难度: 中等查看答案及解析
-
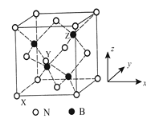
下列有关化学用语表示不正确的是( )
A. Al3+的结构示意图:
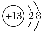 B. K2O的电子式:
B. K2O的电子式: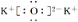
C. CO2分子的结构式:
 D. 苯分子的比例模型:
D. 苯分子的比例模型:
难度: 中等查看答案及解析
-
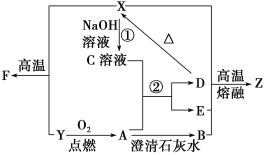
海洋是一座巨大的化学资源宝库,如图是从海水中提取若干种化学物质的流程图,则下列说法正确的是
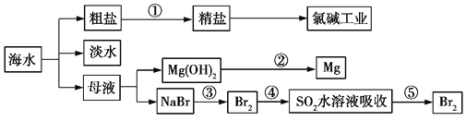
A.除去粗盐中的S、Ca2+、Mg2+、Fe3+等杂质,①中加入试剂的顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.②中包含制取MgCl2溶液、无水MgCl2及电解熔融状态的MgCl2几个阶段
C.③④⑤中溴元素均被氧化
D.蒸馏法是技术最成熟也是最具发展前景的海水淡化方法
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
①氯化钠饱和溶液

 NaHCO3(s)
NaHCO3(s) ② Al2O3
 AlCl3(aq)
AlCl3(aq) Al(OH)3
Al(OH)3③海水
 Mg(OH)2
Mg(OH)2 MgCl2(aq)
MgCl2(aq) MgCl2(s)
MgCl2(s) ④N2
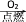 NO2
NO2 HNO3
HNO3⑤重晶石(BaSO4)
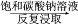 BaCO3
BaCO3 BaCl2(aq)
BaCl2(aq)A. ①③⑤ B. ②③④
C. ②④⑤ D. ①②⑤
难度: 困难查看答案及解析
-
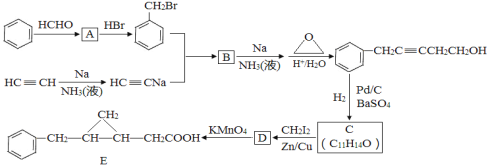
LiAlH4是重要的储氢材料,其组成类似于Na3AlF6。常见的供氢原理如下面两个方程式所示:①2LiAlH4
 2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是
2LiH+2Al+3H2↑,②LiAlH4+2H2O=LiAlO2+4H2↑。下列说法正确的是A. 若反应①中生成3.36L氢气,则一定有2.7g铝生成
B. 氢化锂也是一种储氢材料,供氢原理为LiH+H2O=LiOH+H2↑
C. 生成等质量的氢气,反应①②转移电子数之比为4:3
D. LiAlH4是共价化合物,LiH是离子化合物
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是 ( )
①过量的锌与18 mol·L—1的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2;
④过量铜与浓硫酸;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与块状石灰石
A. ①④⑤ B. ②③⑤
C. ②③④⑥ D. ①②③④⑤⑥
难度: 中等查看答案及解析
-
化学与社会、生活密切相关。对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
用热的烧碱溶液洗去油污
Na2CO3可直接和油污反应
B
漂白粉在空气中久置变质
漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3
C
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
D
FeCl3溶液可用于铜质印刷线路板制作
FeCl3能从含有Cu2+的溶液中置换出铜
难度: 中等查看答案及解析
-
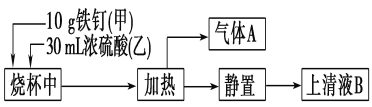
在Fe2(SO4)3溶液中,加入a g铜,完全溶解后,再加b g铁,充分反应后得到c g残余固体,且a>c,则下列说法正确的是( )
A. 最后得到的溶液中一定含有Cu2+ B. 残余固体是铜和铁
C. 将残余固体加入到稀H2SO4中,有气泡产生 D. 最后得到的溶液中可能含有Fe3+
难度: 中等查看答案及解析
 AsH3
AsH3