-
下列各组变化中,化学反应的ΔH前者小于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1; CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH2
②2H2(g)+O2(g)=2H2O(g) ΔH1 2H2(g)+O2(g)=2H2O(l) ΔH2
③S(g)+ O2(g)空气=SO2(g) ΔH1 S(s)+O2(g) 空气=SO2(g) ΔH2
④CaCO3(s)=CaO(s)+CO2(g) ΔH1 CaO(s)+H2O(l)=Ca(OH)2(s) ΔH2
A.①② B.②③ C.①③ D.③④
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A.对于放热反应,升高温度只能加快正反应速率
B.恒压容器N2(g)+ 3H2(g)⇌2NH3(g),充He压强未发生变化,所以反应速率不变
C.用正催化剂使正反应速率和逆反应速率增大的倍数相同
D.恒容容器 2SO2(g)+O2(g)⇌2SO3(g),增大SO3的浓度,会使SO2的反应速率降低
难度: 中等查看答案及解析
-
晶体硅燃烧的热化学方程式:Si(s)+O2(g)=SiO2(s) △H= -989.2 kJ·mol-1,
化学键
Si—O
O=O
Si—Si
键能/kJ·mol-1
X
498.8
176
有关键能数据如表,则表中X的值为( )
A.460 B.920 C.1165.2 D.423.3
难度: 中等查看答案及解析
-
如下图所示,其中甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O
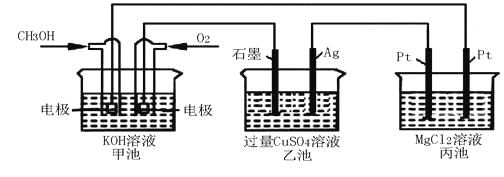
下列说法正确的是
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一小段时间后,向乙池中加入一定量Cu(OH)2固体,能使CuSO4溶液恢复到原浓度
D.甲池中消耗560 mL(标准状况下)O2,此时丙池中理论上最多产生2.9g固体
难度: 困难查看答案及解析
-
下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
难度: 中等查看答案及解析
-
关于下列装置说法正确的是
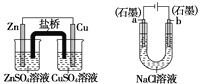
① ② ③ ④
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的OH-浓度增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 中等查看答案及解析
-
对于可逆反应A(g)+3B(s)⇌2C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A.v(A)=0.5 mol·L-1·min-1 B.v(B)=1.2 mol·L-1·min-1
C.v(D)=0.4 mol·L-1·min-1 D.v(C)=0.1 mol·L-1·min-1
难度: 中等查看答案及解析
-
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂,已知:
(1)H2(g)=H2(l) ΔH1=-0.92 kJ·mol-1 (2)O2(g)=O2(l) ΔH2=-6.84 kJ·mol-1
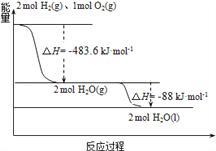
下列说法正确的是
A.H2(g)与O2(g)反应生成H2O(g)放热483.6kJ•mol﹣1
B.氢气的燃烧热为△H=﹣241.8 kJ•mol﹣1
C.火箭中液氢燃烧的热化学方程式为:2H2(l)+O2(l) = 2H2O(g) ΔH=-474.92kJ·mol-1
D.H2O(g) =H2O(l) ΔH=﹣88kJ·mol-1
难度: 中等查看答案及解析
-
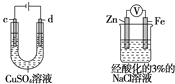
研究电化学腐蚀及防护的装置如下图所示。下列有关说法正确的是

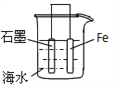
A.d为石墨,铁片不易被腐蚀
B.d为石墨,石墨上电极反应为:O2+2H2O + 4e-=4OH-
C.d为锌块,铁片腐蚀加快
D.d为锌块,铁片上电极反应为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
将等物质的量的N2、H2气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2(g)
 2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )
2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是( )改变条件
新平衡与原平衡比较
A
增大压强
N2的浓度一定变小
B
升高温度
N2的转化率变小
C
充入一定量H2
H2的转化率不变,N2的转化率变大
D
使用适当催化剂
NH3的体积分数增大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰石墨为两极,其电池反应为Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3。下列有关该电池放电时的说法不正确的是( )
A.二氧化锰石墨为电池正极
B.负极反应式为Al-3e-+3NH3·H2O=Al(OH)3+3
C.OH-不断由负极向正极移动
D.每生成1 mol MnO(OH)转移1 mol电子
难度: 中等查看答案及解析
-
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅。[已知反应2NO2(红棕色) ⇌N2O4(无色)]
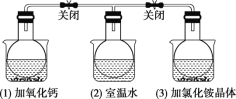
下列叙述正确的是( )
A.2NO2⇌N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气体的平均相对分子质量增大
D.烧瓶(3)中气体的压强增大
难度: 中等查看答案及解析
-
对于反应aA(g)+bB(g) ⇌cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是( )
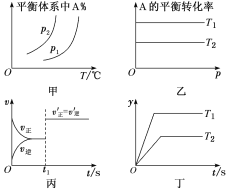
A.图甲中,若p1>p2,则a+b>c+d,ΔH<0
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
难度: 中等查看答案及解析
-
利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
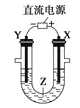
A.氯碱工业中,X电极上反应式是4OH--4e-=2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
难度: 中等查看答案及解析
-
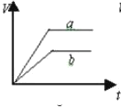
质量相等两份锌粉a和b,分别加入足量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是
A.
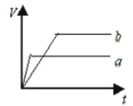 B.
B. 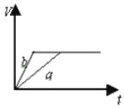
C.
 D.
D. 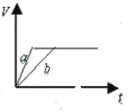
难度: 简单查看答案及解析
-
一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是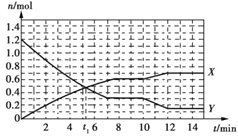
A. t1 min时,正、逆反应速率相等
B. 曲线X表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
难度: 简单查看答案及解析
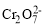 转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。
转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:在25 ℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成了以下实验设计表。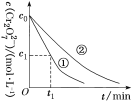
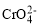 +2H+⇌
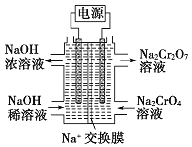
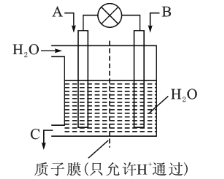
+2H+⇌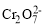 +H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的_____________极,其电极反应式为:__________。
+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的_____________极,其电极反应式为:__________。