-
化学与生产、生活密切相关,下列有关说法正确的是
A.工业上以氯气和澄清石灰水为原料制造漂白粉
B.在制作印刷电路板的过程中常利用铁和氯化铜溶液的反应
C.二氧化硫的大量排放是造成光化学烟雾的主要原因
D.工业上可利用铝热反应原理制备某些高熔点金属,也可用于焊接铁轨
难度: 简单查看答案及解析
-
通过一个阶段的复习,你认为下列说法正确的是
A.在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原
B.在原电池装置中,一定要有两个活泼性不同的金属电极
C.在化合物中,不是电解质就是非电解质
D.对于可逆反应,温度升高则该反应的平衡常数一定增大
难度: 简单查看答案及解析
-
下列有关概念的说法中正确的是
A.在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值
B.在化学反应中,能量较高、能发生碰撞的分子称为活化分子
C.具有相同质子数不同中子数的核素互称同素异形体
D.既可以与酸反应又可以与碱反应生成盐和水的氧化物称为两性氧化物
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.HClO、NaHS、KOH的电子式都可用
表示
B.O2-、Mg2+、Ne、K+的结构示意图都可以用
表示
C.H2O、CO2的比例模型都可以用:
 表示
表示D.氯元素的多种核素都可以用:
(A的数值不同)表示
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移NA个电子
③将2mol NO和1molO2混合后,体系中的分子总数为3NA
④常温下,0.4mol SiO2所含的共价健数目为1.6NA
⑤2mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4L的N2的共用电子对数为3 NA
A.2个 B.3个 C.4个 D.5个
难度: 简单查看答案及解析
-
含有下列各组离子的溶液中,通入(或加入)过量的某种物质后仍能大量共存的是
A.H+、Ba2+、Fe3+、NO3―,通入SO2气体
B.Ca2+、Cl―、K+、H+,通入CO2气体
C.Al(OH)4-、Na+、Br-、SO42-,通入CO2气体
D.HCO3-、Na+、I―、HS―,加入AlCl3溶液
难度: 简单查看答案及解析
-
下列结合实验现象的反应方程式不正确的是
A.在放有金属钠的集气瓶中通入氯气,产生白烟 2Na+Cl2=2NaCl
B.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
C.在0.1 mol·L-1的K2Cr2O7溶液中滴加数滴1mol·L-1的NaOH溶液,溶液由橙色变成黄色
Cr2O72-+H2O
2CrO42-+2H+
D.压缩装有NO2气体的针筒,红棕色先变深后变浅但比原来还是要深2NO2
N2O4
难度: 简单查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是

A. 装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.装置③可用于制取少量纯净的CO2气体
D.装置④可用于比较碳酸钠和碳酸氢钠的热稳定性,大试管A中装碳酸钠固体,小试管B中装碳酸氢钠固体
难度: 简单查看答案及解析
-
下列说法不正确的是
A.用一定量的硫酸溶液进行导电性实验,向其中逐滴加入氢氧化钡溶液,发现,灯泡亮度逐渐变暗,后又逐渐变亮
B.做“氨气的喷泉”实验时,用干燥洁净的烧瓶收集少量氨气,塞上带有玻璃管和胶头滴管(预先吸入少量水)的胶塞,将烧瓶倒置,玻璃管下端浸入水中,挤压胶头滴管,一定能观察到喷泉
C.在配制一定物质的量浓度溶液时,先称量或量取物质,再溶解或稀释,并将溶液转移至容量瓶,洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,继续往容量瓶中加水至溶液的凹液面正好与刻度线相切。该操作缺少用胶头滴管定容步骤
D.把一小块金属钠投入水中,观察到钠浮在水面上,熔成一个小球,四处游动,并发出嘶嘶的响声
难度: 简单查看答案及解析
-
下列图像表达正确的是
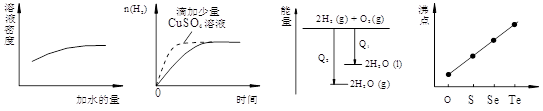
A.稀硫酸的稀释
B.等量的盐酸与过量的锌粉反应
C.氢气与氧气反应中的能量变化
D.气态氢化物沸点
难度: 简单查看答案及解析
-
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρg/cm3,溶质的质量分数为ω,溶质的物质的量浓度为c mol/L。下列叙述中正确的是
A.ω=35a/(22.4Vρ)
B.c =a/(22.4V)mol/L
C.等浓度等体积的上述氨水和氢氧化钠溶液分别与等体积等浓度的稀盐酸反应,两者放出的热量相等
D.在氨水中存在分子间作用力、氢键、共价键
难度: 简单查看答案及解析
-
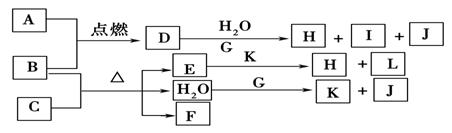
X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是
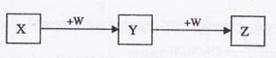
A.若W是强氧化性的单质,则X可能是金属铝
B.若W是氢氧化钠,则X水溶液为酸性
C.若W是单质铁,则Z溶液可能是FeCl2溶液
D.若W是氧气,则X、Z的相对分子质量可能相差48
难度: 简单查看答案及解析
-
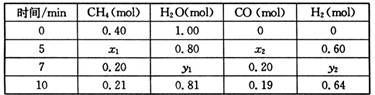
在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)
Ni(CO)4(g),已知该反应平衡常数与温度的关系下表:
温度℃
25
80
230
平衡常数
5×104
2
1.9×10-5
下列说法正确的是
A.上述生成Ni(CO)4(g)的反应为吸热反应
B.25℃时反应Ni(CO)4(g)
Ni(s)+4CO(g)的平衡常数为0.5
C.在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2mol/L
难度: 简单查看答案及解析
-
有反应4HCl+O2→2Cl2+2H2O,已知2molO2被还原时,放出a kJ的热量,且知断开1molO2需要吸收b kJ的热量,断开1molCl2需要吸收c kJ的热量。则断开1 mol H—O键比断开1 mol H—Cl 键所需能量高
A.(a+b-2c)/4 B.(a+2b-4c)/8 C.(b-a-2c)/4 D.(2b-a-4c)/8
难度: 简单查看答案及解析
-
下图表示从混合物中分离出X的两种方案,根据方案I和方案Ⅱ下列说法合理的是
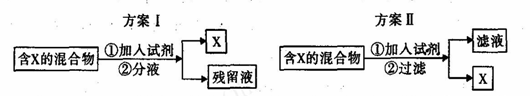
A.若含X的混合物为混有少量氯气的液溴,可通过方案I进行分离,加入试剂为适量溴化钠溶液
B.若含X的混合物为FeCl3和CuCl2,可通过方案I进行分离,加入试剂为过量铁粉
C.若含X的混合物为碘水,可通过方案I进行分离,加入试剂为CC14液体,充分振荡后液体分层,上层为紫红色的X的CC14溶液
D.若含X的混合物为SiO2和Al2O3,可通过方案II进行分离,加入试剂为过量NaOH溶液
难度: 简单查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
HCl
CO2
石灰水
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A.②③④ B. ②③④⑤ C.①③④ D.①②③④
难度: 简单查看答案及解析
-
下列有关电化学的内容正确的是
A.马口铁和白铁皮破损后,白铁皮比马口铁腐蚀快,所以使用白铁皮时要注意防止铁皮出现刮痕
B.原电池中电子从负极流出流入正极,电解池中电子从阴极流出流入电源负极
C.已知磷酸亚铁锂电池总反应为FePO4 + Li
LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4-e-=FePO4+Li+
D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为13(忽略溶液的体积变化)
难度: 简单查看答案及解析
-
化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是
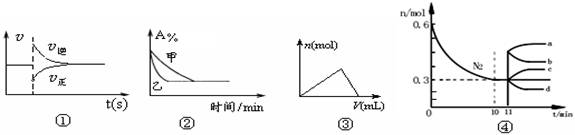
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(g)的影响,且乙的压强大
C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D.图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
难度: 简单查看答案及解析
-
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:
FeCl3+H2S=FeCl2+S;PbO2+4HCl=PbCl2+Cl2↑+2H2O
2Fe(OH)2+Cl2+2KOH=2Fe(OH)3+2KCl;Cl2+2KOH=KCl+KClO+H2O
水溶液中的复分解反应:(Se元素的原子序数为34)
CuSO4+H2S=CuS↓+H2SO4;H2SeO4+2NaN3=Na2SeO4+2HN3;HN3+Na2S=NaN3+H2S
热分解反应:
BaCO3
BaO+CO2↑;MgCO3
MgO+ CO2↑;CuCO3
CuO+ CO2↑
下列说法不正确的是
A.氧化性(酸性溶液):PbO2>Fe3+>S
B.还原性(碱性溶液):Fe(OH)2>KCl>Cl2
C.酸性(水溶液):H2S>H2SO4>H2SeO4>HN3
D.热稳定性:CaCO3>FeCO3>Ag2CO3
难度: 简单查看答案及解析
-
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
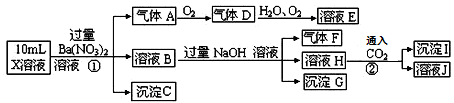
下列说法正确的是
A.气体A是NO2 B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应 D.X中不能确定的离子是 A13+和C1―
难度: 简单查看答案及解析